







 Рейтинг: 4.1/5.0 (1898 проголосовавших)
Рейтинг: 4.1/5.0 (1898 проголосовавших)Категория: Бланки/Образцы
<1> Условия определения антимикробной активности антибиотиков указанных наименований распространяются и на их лекарственные формы.
<2> ATCC - Американская типовая коллекция культур, NCTC - Национальная коллекция типовых культур.
<3> Состав, приготовление сред и буферных смесей см. табл. 19 и 20.
<4> Глюкозу добавляют в расплавленный агар в виде 40% стерильного раствора.
<5> Объемы сред указаны для чашек размером 20 х 100 мм. При использовании лунок количество среды для нижнего или одного слоя удваивается.
<6> Допускается уменьшение или увеличение посевной дозы тест - микроба в зависимости от плотности получаемого газона и четкости очертания зон.
<7> В таблице указана контрольная концентрация раствора стандартного образца для метода с использованием стандартной кривой.
<8> Допускается при необходимости уменьшение или увеличение контрольной концентрации раствора стандартного образца.
<9> Для полного растворения препарата раствор помещают в холодильник при температуре от 4 до 10 град. С.
<10> Активность канамицина В определяется после гидролиза по стандартному образцу канамицина А.
<11> Срок годности рабочих растворов в буфере при комнатной температуре не более 30 мин.
<12> Срок годности основного раствора стандартного образца микогептина при комнатной температуре не более 4-5 ч.
<13> Основной раствор готовят в концентрации 1 мг в 5 мл раствора натра едкого (0,1 моль/л).
Среда N 8 - для выращивания Pseudomonas aeruginosa и Staphylococcus aureus:
рН после стерилизации 7,3 +/-0,2.
Пептон и соли растворяют в воде при нагревании, вносят глюкозу, устанавливают рН, кипятят 1 мин, фильтруют через бумажный фильтр. Стерилизуют в паровом стерилизаторе насыщенным паром под давлением при температуре 121 град. С в течение 15 мин.
Среда N 9 - для выявления пигмента пиоцианина:
рН после стерилизации 7,2 +/-0,2.
Все компоненты, кроме глицерина, растворяют в воде и оставляют на 15 мин. Затем вносят глицерин, тщательно перемешивают, растворяют при нагревании, устанавливают рН, кипятят 1 мин, прибавляют замоченный заранее агар, нагревают до полного его расплавления, фильтруют через ватно - марлевый фильтр. Стерилизуют в паровом стерилизаторе насыщенным паром под давлением при температуре 121 град. С в течение 15 мин.
Среда N 10 - для идентификации Staphylococcus aureus:
рН после стерилизации 7,4 +/-0,2.
Все компоненты растворяют в воде, вносят 2,5 мл 1% раствора фенолового красного, устанавливают рН, кипятят 1 мин, прибавляют замоченный заранее агар, нагревают до полного его расплавления, фильтруют через ватно - марлевый фильтр. Стерилизуют в паровом стерилизаторе насыщенным паром под давлением при температуре 121 град. С в течение 15 мин.
Требования к ростовым свойствам питательных сред. Используемые питательные среды должны обеспечивать рост соответствующих тест - штаммов бактерий и грибов, указанных в табл. 17, при посеве их в количестве менее 100 жизнеспособных клеток: для сред N 1, 3, 6 - 10 не позднее 48 ч инкубации при температуре от 30 до 35 град. С и для среды N 2 - не позднее 72 ч инкубации при температуре от 20 до 25 град. С.
Фосфатный буферный раствор с натрия хлоридом и пептоном (1/15 мол):
Стерилизуют в паровом стерилизаторе насыщенным паром под давлением при температуре 121 град. С в течение 15 мин. Раствор хранят при температуре от 4 до 10 град. С.
Феноловый красный - 1% раствор:
Навеску индикатора растирают в ступке, прибавляя небольшими порциями едкий натр. Полученный раствор переносят в мерную колбу вместимостью 100 мл и доводят объем раствора водой до метки. Хранят во флаконе нейтрального светозащитного стекла при температуре от 4 до 10 град. С.
Малахитовый зеленый - 0,5% раствор:
Навеску красителя переносят в стеклянный флакон, прибавляют стерильную горячую воду, помещают на сутки в термостат, периодически встряхивая.
Реактив Грисса. Раствор N 1: 0,5 г сульфаниловой кислоты растворяют в 30 мл ледяной уксусной кислоты, прибавляют 100 мл воды, фильтруют. Раствор годен в течение месяца.
Раствор N 2: 0,1 г 1-нафтиламина растворяют в 100 мл кипящей воды, охлаждают, прибавляют 30 мл ледяной уксусной кислоты, фильтруют. Раствор годен в течение 7 сут.
Перед употреблением смешивают равные объемы растворов N 1 и N 2.
Реактив на цитохромоксидазу. Раствор N 1: 1% спиртовой раствор нафтола-1.
Раствор N 2: 1% раствор N, N - диметил - р - фенилендиамина дигидрохлорида.
Перед употреблением смешивают растворы N 1 и N 2 в соотношении 2:3.
Растворы годны в течение 14 сут при хранении при температуре от 4 до 10 град. С во флаконах нейтрального светозащитного стекла.
ОПРЕДЕЛЕНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ
АНТИБИОТИКОВ МЕТОДОМ ДИФФУЗИИ В АГАР
Определение антимикробной активности антибиотиков основано на их способности угнетать рост микроорганизмов. Определение проводят методом диффузии в агар на плотной питательной среде путем сравнения размеров зон угнетения роста тест - микробов, образующихся при испытании растворов определенных концентраций Государственного стандартного образца <*> и испытуемого препарата.
<*> Далее "стандартный образец" следует читать "Государственный стандартный образец".
Антимикробная активность антибиотиков выражается в единицах действия - ЕД или "мгк". Для большинства антибиотиков 1 ЕД или "мкг" соответствуют 1 мкг активного вещества (кислоты или основания); для антибиотиков, имеющих иное количественное выражение единицы, соответствующие указания даются в частных статьях.
При определении антимикробной активности антибиотиков используют стандартные образцы, активность которых, как правило, устанавливают в соответствии с Международными биологическими стандартами. При отсутствии последних для указанных целей могут быть использованы международные химические стандарты, антимикробную активность которых рассчитывают на основании показателей качества, установленных физико - химическими методами. Антимикробную активность стандартных образцов антибиотиков, не имеющих аналогов в международной коллекции стандартов, рассчитывают также на основании показателей качества, установленных физико - химическими методами.
Стандартные образцы антибиотиков утверждаются и рассылаются Государственным научно - исследовательским институтом по стандартизации и контролю лекарственных средств Минздрава СССР, хранятся и используются в соответствии с рекомендациями, указанными на этикетке стандартного образца.
Метод определения. Тест - микробы, растворители, буферные растворы, питательные среды и прочие условия проведения испытания указаны в табл. 18.
В чашки Петри (стеклянные или пластмассовые), установленные на столиках со строго горизонтальной поверхностью, разливают расплавленные питательные среды определенного состава в один или два слоя. Для нижнего слоя используют незасеянные среды, для верхнего или одного слоя - агаровую среду, предварительно засеянную соответствующим тест - микробом. Если культура представляет собой суспензию вегетативных клеток, то температура расплавленной среды, в которую вносят тест - микроб, должна быть (49 +/-1) град. С, при использовании суспензии спор - 65-70 град. С. К среде следует добавить такое количество суспензии вегетативных клеток или спор, которое обеспечивает оптимальный рост тест - микроба и четкость зон угнетения его роста.
Характеристика культуральных свойств тест - микроба
Шесть стерильных цилиндров единого размера и массы, высотой (10,0 +/-0,1) мм и внутренним диаметром (6,0 +/-0,1) мм, из нержавеющей стали или алюминия расставляют на поверхности засеянной среды на равном расстоянии друг от друга и от края чашки. Вместо цилиндров могут быть использованы лунки диаметром от 6 до 8 мм, сделанные в толще агара с помощью стерильного сверла либо другого соответствующего приспособления.
В цилиндры или лунки каждой чашки вносят равные объемы рабочих растворов стандартного и испытуемого образцов. Основные растворы стандартных и испытуемых образцов готовят в стерильных растворителях с концентрацией 1 мг/мл. Затем из основных растворов в зависимости от применяемого варианта метода диффузии в агар (трехдозного или с построением стандартной кривой) готовят рабочие растворы трех или одной концентраций испытуемого образца и растворы трех или пяти концентраций стандартного образца.
Рабочие растворы испытуемых образцов готовят из основных растворов таким образом, чтобы их концентрации не имели существенных отличий от концентраций раствора стандартного образца.
Для уменьшения влияния колебаний во времени между закапыванием растворов, используемых в опыте, рекомендуется после их внесения выдерживать чашки при комнатной температуре в течение 1-2 ч. Затем чашки инкубируют при температуре (36 +/-1) град. С в течение 16-18 ч.
Диаметры зон угнетения роста тест - микроба при помощи соответствующих приборов измеряют с точностью до 0,1 мм.
Определение антимикробной активности антибиотиков с использованием трехдозного варианта метода диффузии в агар. Для проведения испытания готовят три раствора стандартного образца (C1, С2, С3) и три раствора испытуемого образца (И1, И2, И3). Концентрации растворов, содержащих малую, среднюю и большую дозы, должны находиться между собой в кратном соотношении (1:2:4). При необходимости это соотношение может быть изменено. Концентрация раствора С2 должна быть близка контрольной концентрации раствора стандартного образца, указанной в табл. 17.
Все растворы стандартного и испытуемого образцов вносят в цилиндры или лунки одной чашки Петри таким образом, чтобы растворы с большими концентрациями не соприкасались между собой. Предлагаемый вариант закапывания С1И3С2И1С3И2.
Число чашек, используемых в каждом опыте, должно быть достаточным для обеспечения статистической достоверности результатов, но не менее 6 чашек.
Последовательность внесения растворов стандартного и испытуемого образцов в цилиндры или лунки каждой чашки должна быть следующей: первым вносят раствор с малой концентрацией стандартного образца (C1) и соответствующий раствор испытуемого образца (И1). Затем растворы со средней концентрацией (С2 и И2), последними вносят растворы с большими концентрациями (С3 и И3).
Определение антимикробной активности антибиотиков с использованием стандартной кривой. Постановка опыта. В день постановки анализа из основного раствора готовят пять рабочих растворов стандартного образца C1, С2, С3, С4, C5 с концентрациями, увеличивающимися в геометрической прогрессии (Z), обычно в соотношении 1:1,25. Средняя концентрация (С3) является контрольной и должна быть близка к концентрации, указанной в табл. 17: концентрация C1 - наименьшая, C5 - наибольшая. Для исследования растворов каждой концентрации (кроме контрольной) используют по три чашки. Раствор контрольной концентрации С3 закапывают в три цилиндра (или лунки) каждой из взятых в опыт чашек, в три другие цилиндра (лунки) закапывают раствор одной из концентраций стандартного образца, чередуя его с раствором контрольной концентрации. Таким образом, для построения стандартной кривой используют 12 чашек.
После инкубации в термостате измеряют диаметры зон угнетения роста тест - микробов. Далее вычисляют среднюю величину диаметров зон для раствора контрольной концентрации стандартного образца в каждой группе из трех чашек, затем среднюю величину диаметров зон для раствора контрольной концентрации стандартного образца из всех 12 чашек (общую среднюю из 36 зон). По разности между средней величиной зоны контрольной концентрации, установленной из 12 чашек, и средней величиной зоны контрольной концентрации, установленной из 3 чашек с каждой отдельной концентрацией, находят поправку к величине зоны данной концентрации. Найденную поправку прибавляют к средней величине диаметра зоны данной концентрации, если она положительная, и вычитают, если она отрицательная.
Пример. Общая средняя величина зоны для раствора контрольной концентрации стандартного образца 1 мкг/мл, рассчитанная из 36 зон, равна 19,2 мм. Средняя величина зоны для раствора той же концентрации, установленная из 3 чашек, на которых испытывался раствор с концентрацией 0,83 мкг/мл стандартного образца, равна 19 мм. Следовательно, величина поправки будет +0,2 мм. Средняя величина зоны для концентрации 0,83 мкг/мл равна 17,9 мм; прибавляя поправку +0,2 мм, получаем величину 18,1 мм. Таким образом исправляют значение величины зон для растворов всех концентраций стандартного образца и получают величины d1, d2, d4, d5.
Для исследования активности испытуемого образца проводят несколько определений, используя для каждого по 3 чашки, в которые закапывают раствор контрольной концентрации стандартного образца и раствор испытуемого образца с концентрацией, близкой к контрольной. Внесение растворов контрольной концентрации стандартного и испытуемого образцов в каждой группе из трех чашек должно проводиться одномоментно. После инкубации измеряют зоны угнетения роста тест - микроба, образуемые растворами контрольной концентрации стандартного и испытуемого образцов. Находят среднее значение величин зон из 3 чашек.
Расчет антимикробной активности испытуемых образцов по стандартной кривой может быть проведен двумя способами: графическим методом или путем непосредственного расчета с использованием соответствующих формул.
Расчет активности испытуемого образца графическим методом. По исправленным значениям диаметров зон d1, d2, d4, d5 для всех концентраций растворов стандартного образца C1, C2, С4, C5 и общей средней величине диаметров зон для контрольной концентрации d3 вычисляют с использованием метода наименьших квадратов размеры зон Dmin и Dmax для низкой и высокой концентраций растворов стандартного образца:
Dmin = (3d1 + 2d2 + d3 - d5) / 5;
Dmax = (3d5 + 2d4 + d3 - dl) / 5,
по которым затем строят стандартную кривую на полулогарифмической сетке расчета биологической активности антибиотиков, откладывая на оси абсцисс величины зон, на оси ординат - соответствующие им концентрации растворов стандартного образца. Разность между найденными средними величинами зон угнетения роста тест - микроба раствором испытуемого образца и раствором контрольной концентрации стандартного образца из тех же чашек прибавляют к значению величины зоны, соответствующей контрольной концентрации на кривой (D3). Затем по кривой находят концентрацию, соответствующую найденной величине зоны. Умножением полученной концентрации на степень разведения получают активность в 1 мл основного раствора или в 1 мг испытуемого образца.
Пример. Средний размер зон для раствора испытуемого образца при разведении 1:300 составляет 18,7 мм, средний размер зон для раствора стандартного образца, содержащего 2 мкг/мл (контрольная концентрация) из тех же чашек - 18,5 мм. Следовательно, разность составляет + 0,2 мм. Эту разность прибавляют к величине зоны для раствора в концентрации 2 мкг/мл по стандартной кривой, которая равна D3 = 18,6 мм, и получают величину 18,8 мм. Находят на кривой концентрацию, соответствующую данному размеру зоны - 2,36 мкг/мл. Эту величину умножают на степень разведения и получают содержание активного вещества в 1 мл основного раствора, т. е. 2,36 мкг/мл х 300 = 708 мкг/мл.
Так как концентрация основного раствора составляла 1 мг/мл, то активность испытуемого образца равна 708 мкг/мл: 1 мг/мл = 708 мкг/мл.
Определение активности испытуемого образца расчетным путем. Кривая, отражающая зависимость между активностью антибиотика и размером зоны угнетения роста тест - микроба, после перехода к координатам логарифм концентрации (lg C) - диаметр зоны (D) преобразуется в прямую, уравнение которой:
где а - свободный член; b - угловой коэффициент.
По исправленным значениям величин диаметров зон d1, d2, d4, d5 для растворов стандартного образца с концентрациями C1, С2, С4, С5 и общей средней величине диаметра зоны d3, соответствующей контрольной С3, рассчитывают величины а и b с применением метода наименьших квадратов. Так как концентрации C1, С2, С3, С4, C5 составляют геометрическую прогрессию, формулы для вычисления коэффициентов а и Ь могут быть записаны в виде:
b = (-2 x d1 - d2 + d4 + 2 x d5) / 10 x lg Z;
a - d - Ь x lg C3,
где Z - знаменатель прогрессии разведения;
Пример. Пусть знаменатель прогрессии разведения Z = 1,25, С3 = 5,0, а средние значения диаметров зон (в мм) равны: d1 = 17,64; d2 = 18,15; d3 = 19,03; d4 = 19,58; d5 = 20,09. Тогда:
Если в опыте с одной стандартной кривой проведено n испытаний образца, то логарифм среднего значения концентрации испытуемого образца в опыте рассчитывают по формуле:
Поскольку микробиологическое исследование активности антибиотиков подвержено вариабельности, следует проводить не менее 6 повторных испытаний в разные дни (не менее 2 дней), так как средняя активность отдельных определений, проведенных в разные дни, - более надежная величина, чем средняя активность, полученная в результате такого же количества определений, проведенных одновременно.
Расчет ошибки определения логарифма концентрации испытуемого образца в пределах одного опыта приведен в приложении 1 к настоящей статье. Объединение результатов отдельных опытов проводят в соответствии с формулами, приведенными в приложении 2 к настоящей статье.
Во всех сомнительных случаях и при определении активности стандартных образцов должен использоваться только трехдозный вариант метода диффузии в агар.
Для определения содержания активного вещества во флаконе активность, найденную в 1 мг, умножают на массу содержимого флакона, выраженную в миллиграммах. При исследовании раствора, приготовленного из всего содержимого флакона или ампулы, активность, найденную в 1 мл этого раствора, умножают на его объем. В случае необходимости определения содержания активного вещества в 1 мг испытуемого образца следует величину, характеризующую содержание активного вещества во флаконе, разделить на массу содержимого флакона, выраженную в миллиграммах.
При определении содержания активного вещества в таблетках или капсулах их количество, а также подготовка для анализа должны соответствовать требованиям общих статей ГФ XI издания "Таблетки" (с. 154) и "Капсулы" (с. 143). В дальнейшем основной раствор испытуемого образца готовят из расчета 1 мг в 1 мл. После перемешивания раствору дают отстояться или центрифугируют. Рабочий раствор испытуемого образца готовят разведением надосадочной жидкости основного раствора. Для определения содержания активного вещества в 1 таблетке или капсуле активность 1 мг порошка растертых таблеток или содержимого капсул умножают на среднюю массу таблетки или содержимого капсулы, выраженную в миллиграммах.
При исследовании таблеток, покрытых оболочкой, активность определяют в нескольких растворенных таблетках, количество которых и растворитель должны быть указаны в частных статьях. Активность, найденную в 1 мл основного раствора, умножают на его объем и делят на количество растворенных в этом объеме таблеток.
Выращивание и хранение культур тест - микробов <*>. Все культуры тест - микробов сохраняют в запаянных пробирках на соответствующих плотных питательных средах в течение 15-30 сут при температуре от 4 до 10 град. С, после чего пересеивают на свежую питательную среду. Тест - микробы можно сохранять и в лиофилизированном состоянии.
<*> Штаммы тест - микробов, за исключением Candida utilis ЛИА-01, применяемые для определения антимикробной активности антибиотиков, хранятся в музее патогенных и условно патогенных культур при Государственном научно - исследовательском институте стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича. Candida utilis ЛИА-01 хранится во Всесоюзном научно - исследовательском технологическом институте антибиотиков и ферментов медицинского назначения (ВНИТИАФ).
Для характеристики культурных свойств микроорганизмов (см. табл. 18) производится их высев в пробирки с мясо - пептонным бульоном (МПБ), затем через 18-20 ч инкубации при температуре (36 +/-1) град. С культуры высеивают на чашки Петри с плотной средой для выделения типичных колоний, которые затем пересевают на соответствующие питательные среды для получения в дальнейшем взвесей вегетативных клеток или спор. Взвесь хранят в запаянных стеклянных пробирках при температуре от 4 до 10 град. С в течение определенного срока.
В полученной взвеси определяют концентрацию клеток (спор) по оптическому стандарту мутности <*> или нефелометрически (основная взвесь). Из этой взвеси по мере надобности готовят рабочую взвесь в соответствии с посевной дозой, предусмотренной для каждого тест - микроба (см. табл. 17).
<*> Оптические стандарты мутности и инструкция по их использованию выпускаются и рассылаются Государственным научно - исследовательским институтом стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича.
Культуру тест - микроба Staphylococcus aureus 209P высевают на чашки Петри со средой N 1 и после выращивания в течение 18-20 ч при (364 +/-1) град. С оставляют при комнатной температуре на 24 ч для наблюдения за образованием пигмента. Отбирают типичные колонии и пересевают их в пробирки со скошенным агаром того же состава.
Для определения активности используют взвесь 18-20-часовой культуры стафилококка, выращенной в пробирке на скошенном агаре. Возможно также применение в течение длительного времени взвеси культуры, полученной следующим образом: культуру выращивают в течение 18-20 ч на скошенном агаре в пробирке, смывают ее 5-10 мл стерильного раствора хлорида натрия изотонического 0,9%. Полученной взвесью засевают матрац с 300 мл среды N 1 (со скошенной поверхностью), выращивают в течение 2 сут [сутки при (36 +/-1) град. С и сутки при комнатной температуре], смывают примерно 50 мл стерильного раствора хлорида натрия изотонического 0,9%. Взвесь культуры можно хранить в запаянных пробирках в течение 5-7 нед при температуре от 4 до 10 град. С.
Культуру тест - микроба Bordetella bronchiseptica (ATCC 4617 гладкая форма) выращивают так же, как указано для Staphylococcus aureus 209P, за исключением времени инкубации, которое составляет для Bordetella bronchiseptica 30-36 ч. Посевным материалом служит культура, выращенная в пробирках со скошенным агаром и хранящаяся при температуре от 4 до 10 град. С не более 2 нед. Для длительного применения взвеси клеток культуру смывают с питательной среды 5-10 мл стерильного раствора натрия хлорида изотонического 0,9%, засевают матрац со средой N 1 (со скошенной поверхностью) и далее поступают так же, как при подготовке культуры Staphylococcus aureus 209P. Взвесь клеток Bordetella bronchiseptica ATCC 4617 может храниться в течение 7 сут.
Культуру тест - микроба Pseudomonas aeruginosa N CTC 2134 выращивают на чашках Петри со средой N 1 в течение 18-20 ч при температуре (36 +/-1) град. С, отбирают типичные колонии, пересевают их на мясо - пептонный бульон рН от 7,2 до 7,4 и выращивают в вышеуказанных условиях. Полученная культура служит посевным материалом для приготовления суточной культуры, используемой при определении активности в каждом конкретном опыте, и может храниться в течение 30 сут при температуре от 4 до 10 град. С.
Культуру тест - микроба Candida utilis ЛИА-01 выращивают на чашках Петри со средой N 3 в течение 48 ч при температуре (30 +/-1) град. С, отбирают типичные колонии, пересевают их в пробирки со скошенным агаром того же состава и выращивают в указанных выше условиях. Полученная культура служит посевным материалом для приготовления взвеси клеток, применяемой в течение длительного времени. Для этого культуру с поверхности среды смывают 5-10 мл стерильного раствора натрия хлорида изотонического 0,9% и засевают матрац с 300 мл среды N 3 (со скошенной поверхностью). Через 2 сут культуру смывают 50 мл стерильного раствора натрия хлорида изотонического 0,9%. По мере надобности готовят рабочую взвесь, густота которой должна быть такой, чтобы при разведении ее в 30 раз 0,9% раствором натрия хлорида изотонического оптическая плотность составляла 0,22-0,23. Для определения густоты взвеси используют нефелометр с нейтральным светофильтром и кюветы с толщиной слоя 3 мм. Рабочая взвесь может храниться в течение 30 сут.
При использовании спорообразующих культур тест - микробов процесс выращивания на чашках Петри, отбор типичных колоний, пересев на пробирки со скошенным агаром и на матрацы осуществляют так же, как указано для Staphylococcus aureus 209P.
Для выращивания культур тест - микробов Вас. subtilis, var. Л2 и Вас. pumilus N CTC 8241 на чашках Петри и пробирках используют среду N 1, при выращивании на матрацах - среду N 4; для выращивания культур тест - микробов Вас. cereus, var. mycoides HB и Вас. subtilis ATCC 6633 на чашках Петри и пробирках используют среду N 1, при выращивании на матрацах - среду N 5; для выращивания культуры тест - микроба Вас. cereus, var. mycoides 537 на чашках Петри и на пробирках используют среду N 2, при выращивании на матрацах - среду N 4.
Для получения взвеси спор культуру, выращенную в пробирках, смывают 5-10 мл стерильного раствора натрия хлорида изотонического 0,9%, засевают ею несколько матрацев с 300 мл питательной среды (со скошенной поверхностью) и выращивают в течение 5-7 сут. В процессе выращивания периодически производят микроскопический контроль культуры, и если в мазках, окрашенных по Граму, имеется в поле зрения 80-90% спор, производят смыв стерильной дистиллированной водой.
Полученную взвесь спор прогревают при температуре от 60 до 70 град. С в течение 30 мин. Затем промывают стерильной дистиллированной водой при центрифугировании до полной прозрачности надосадочной жидкости. Промытую взвесь спор вновь прогревают в течение 30 мин при температуре от 60 до 70 град. С. Взвесь спор хранят в запаянных стеклянных пробирках при температуре от 4 до 10 град. С и используют до тех пор, пока интенсивность роста и четкость зон при определении антимикробной активности препаратов удовлетворяют предъявляемым требованиям.
Для заражения питательных сред допускается использование лиофилизированных тест - культур с точно известным содержанием количества микробных клеток (спор) в ампуле, которые после суспендирования в соответствующем растворителе (растворе натрия хлорида изотонического 0,9% или дистиллированной воде) вносят в питательную среду без предварительного пересева.
Питательные среды и буферные растворы. В табл. 19 представлен состав сред, используемых при определении активности антибиотиков.
Для приготовления сред N 4, 5, 6, 7, 8, 9, 10, 13, 14, 15, 16 применяют ферментативный гидролизат биомассы микроорганизмов без оболочек. Методика приготовления состоит в следующем: 5 г сухого ферментативного гидролизата размешивают в 1 л дистиллированной воды, прибавляют агар - агар, расплавленный в открытом котле или автоклаве текучим паром или под давлением 0,05 МПа и температуре (111 +/- 1) град. С в течение 30 мин. В случае необходимости в среду прибавляют соли в количестве, указанном в прописи сред; рН сред определяют потенциометрически со стеклянными электродами или колориметрически. Реакцию среды (рН) корригируют хлористоводородной кислотой или раствором едкого натрия.
Готовые среды разливают в соответствующую посуду и стерилизуют в автоклаве при 0,1 МПа и температуре (120 +/- 1) град. С в течение 15 мин.
Состав питательных сред для выращивания
тест - культур, получения спор и
определения активности антибиотиков
Табуреточных дел мастер Просветленный (41037), закрыт 9 лет назад
Елена Киселева Мыслитель (8446) 9 лет назад
ДОЗА (греч. dosis — порция) — определенное количество лекарственного препарата. При лечении Д. устанавливается врачом в зависимости от возраста больного (детям соответственно возрасту и пожилым людям Д. уменьшается). индивидуальных особенностей организма (ослабленность, истощение). а также характера заболевания, его течения. Д. зависит также от способа введения лекарства в организм. Д. применяемая па один прием, называется разовой, на сутки — суточной.
Государственной фармакопеей СНГ (сборник стандартов и положений, нормирующих качество лекарственных средств; имеет законодательное значение) установлены высшие дозы (разовые и суточные). к-рые нельзя превышать при отсутствии специальных показаний. Однако в нек-рых случаях, чтобы оборвать развитие тяжелого заболевания, врач может назначить лекарство в Д. превышающей разовую (т. паз. ударная Д.). для создания необходимой концентрации лекарственного вещества в крови. Д. могущая вызвать отравление, называется токсической, а влекущая смерть — летальной. Д. жидких лекарственных веществ выражается в ложках (столовая ложка —15 мл, десертная —7,5 мл, чайная — 5 мл) и в каплях, а сухих лекарственных веществ — в граммах и долях грамма; в нек-рых случаях (антибиотики, эндокринные препараты) доза устанавливается также в «единицах действия» (ЕД) или международных (ME), или интернациональных (ИЕ) единицах.
МО- это наверное, МЕ? - международная единица
Единицы биологической активности. Выражение величин биологической активности антибиотиков обычно производят в условных единицах, содержащихся в 1 мл раствора (ед/мл) или в 1 мг препарата (ед/мг). За единицу антибиотической активности принимают минимальное количество антибиотика, способное подавить развитие или задержать рост стандартного штамма тест-микроба в определенном объеме питательной среды. Единицей антибиотической активности пенициллина считают минимальное количество препарата, способное задерживать рост золотистого стафиллококка штамм 209 в 50 мл питательного бульона. Для стрептомицина единица активности будет иной, а именно: минимальное количество антибиотика, задерживающее рост E. сoli в одном миллилитре питательного бульона. После того как многие антибиотики были получены в химическом чистом виде, появилась возможность для ряда из них выразить условные единицы биологической активности в единицах массы. Установлено, что 1 мг чистого основания стрептомицина эквивалентен 1000 единицам биологической активности. Следовательно, одна единица активности стрептомицина эквивалентна одному микрограмму (мкг) чистого основания этого антибиотика. В связи с этим в настоящее время в большинстве случаев количество стрептомицина выражают в мкг/мг или в мкг/мл. Чем ближе число мкг/мг в препаратах стрептомицина стоит к 1000, тем, следовательно, чище данный препарат, тем меньше он содержит балластных веществ. У таких антибиотиков, как карбомицин, эритромицин, новобиоцин, нистатин, трихотецин и некоторых других, одна единица активности эквивалентна или приблизительно эквивалентна 1 мкг вещества. Однако у ряда антибиотиков единица биологической активности значительно отличается от 1 мкг вещества. Например, 1 мг чистого основания неомицина содержит 300 ед. активности. Поэтому 1 единица активности этого антибиотика эквивалентна 3,3 мкг. Для бензилпенициллина 1 ед активности эквивалентна примерно 0,6 мкг, так как 1 мкг антибиотика содержит 1667 ед. (оксфордских). Для фумагиллина за единицу фагоцидного действия принято брать 0,1 мкг чистого вещества. 1 единица бацитрацина эквивалентна 20 мкг вещества.
У таких антибиотиков, как карбомицин, эритромицин, новобиоцин,
нистатин, трихотецин и некоторых других, одна единица активности
эквивалентна или приблизительно эквивалентна 1 мкг вещества.
Однако у ряда антибиотиков единица биологической активности
значительно отличается от 1 мкг вещества. Например, 1 мг чистого основания
неомицина содержит 300 ед. активности.
Источник: врач, клинический фармаколог
Алена Гуру (3028) 9 лет назад
в МЕ-международные единицы.
Дмитрий Соловьёв Искусственный Интеллект (176429) 9 лет назад
В каких единицах.
Или в граммах, типа 0,25, 0,5. Или в "кубиках", т.е. см в кубе.
Zina Zeta Оракул (85664) 9 лет назад
Миллионы единиц, не знаю никаких международных единиц я. Рассчитываются на вес пациента. Столько то на кг веса. Очень хорошо снижают иммунитет, вынося всю нормальную микрофлору в первую очередь и иногда оставляя нетронутой патогенную, против которой они были назначены собственно говоря.
0000 0000 Просветленный (43096) 9 лет назад
Нет такого МО. Может быть Ммоль? Количество антибиотика измеряется в ЕД- единицах действия. Верно ,Zina Zeta. Дозировка зависит от веса больного.
Нейрофизиолог Просветленный (48025) 9 лет назад
Елена Киселёва дала Вам квалифицированный ответ. Добавлю только, что в международных единицах (МЕ) измеряются антибиотики, гормоны, цитостатические средства и т.п.
Биологическая активность антибиотиков.
Биологическая активность антибиотика – это его способность убивать или тормозить рост и развитие микроорганизмов. Активность выражают в единицах действия (ЕД). 1 ЕД - минимальное количество антибиотика, которое задерживаетрост стандартного штамма тест-микроба в определенных условиях. Так, для пенициллина 1 ЕД является минимальное количество, способное задержать рост золотистого стафилококка штамма 209-р в 50 мл МПБ. Для стрептомицина 1 ЕД должна задерживать рост E.coli в 1 мл МПБ.
В настоящее время активность большинства антибиотиков измеряется в мкг . Обычно 1мкг химически чистого препарата соответствует 1 ЕД. Для бензилпенициллина 1мг содержит 1670 ЕД, в 1 мг нистатина содержится 4000 ЕД.
Активность антибиотиков определяют:
1) методом серийных разведений ;
2) методом диффузии в агар .
Для определения активности антибиотиков в качестве тест - культуры используют непатогенные или условно-патогенные микробы, проявляющие наибольшую чувствительность к данному веществу. Так, для определения активности пенициллина используют S. аureus 209-р.
1. Определение активности антибиотиков методом серийных разведений. Берут ряд пробирок с одинаковым объемом МПБ (1-10 мл). Количество пробирок определяется количеством разведений (степенью разведения) антибиотика. В первую пробирку вносят определенное количество антибиотика, перемешивают, определенный объем раствора переносят из первой пробирки во вторую, перемешивают, из второй пробирки – в третью и т.д. Из последней пробирки такой же объем выливают, чтобы во всех пробирках содержался одинаковых объем жидкости. Контроль – пробирка без антибиотика. Во все пробирки с разведениями антибиотика и контрольную пробирку вносят 0,1 мл взвеси тест культуры (2,5 ×10 6 клеток в 1 мл). На следующий день определяют разведение антибиотика, при котором в пробирке нет роста - среда осталась прозрачной (если нет роста, следовательно антибиотик подействовал). Эта наименьшая концентрация и есть минимальная активная доза антибиотика.
Можно использовать этот метод с применением плотной среды, в том случае, если микробы не растут на жидких средах (для туберкулезных палочек – свернутую сыворотку). Разведения антибиотика в среде готовят следующим образом. Вначале готовят различные разведения антибиотика в растворителе, а затем по 1 мл каждого разведения вносят в пробирку с 4 мл расплавленного и охлажденного до 45-50°С МПА. Пробирки скашивают для застывания агара, а на поверхность среды петлей засевают тест-культуру.
2. Определение активности антибиотика методом диффузии в агар.
Питательный агар (ПА) по 15 мл разливают в чашки Петри. После застывания и подсушивания агара в каждую чашку наливают по 5 мл ПА, смешанного с тест культурой (20 млн. клеток на 1 мл среды). После застывания второго слоя агара на его поверхность наносят по трафарету 6 цилиндров и делают 6 лунок. В 3 лунки вносят по 0,1 мл испытуемого раствора антибиотика, в другие 3 лунки – по 0,1 мл стандартного раствора. Через 16-18 часов термостатирования при 37°С цилиндры удаляют и измеряют диаметр зон задержки роста. Активность антибиотика устанавливается с помощью расчетной таблицы ГФК или по стандартной кривой на основе диаметра задержки роста.
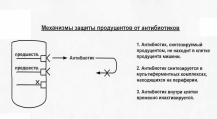
Под названием «антибиотики» принято подразумевать вещества, продуцируемые микробами или другими более высокоразвитыми растительными и животными организмами, обладающие антибактериальной активностью.
Для оценки химиотерапевтических свойств того или иного антибиотика принята биологическая активность. Способность убивать микроорганизмы или тормозить рост и развитие называют биологической активностью препарата. Для количественного выражения биологической активности введено понятие единицы действия (ЕД). ЕД - это активность определенной массы антибиотика, принятого за стандарт. Единицы действия каждого антибиотика указаны в соответствующих фармакопейных статьях.
В качестве стандарта используют максимально чистые образцы антибиотического вещества с заранее вычисленными теоретическими величинами активностей, которые определяются химической структурой соединений - стандартов и весовым выражением их единиц действия (табл. 14).
Для определения биологической активности антибиотиков наряду с микробиологическим применяют химические и физико-химические методы.
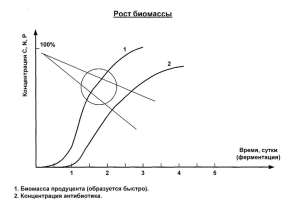
Для равномерного и непрерывного процесса производства антибиотиков во всех стадиях необходимо подвергать процесс систематическому и целенаправленному аналитическому контролю. С этой целью в контрольно-аналитических заводских лабораториях проводят предварительный контроль сырья и вспомогательных веществ, межоперационный контроль как ферментации, так и химической очистки, контроль готового продукта.
Сырье для ферментации антибиотиков контролируется как биологически, так и химически. Большинство питательных субстратов, применяемых в производстве антибиотиков, является веществами растительного или микробного происхождения. Пригодность такого вида сырья определяют путем ферментации в малом объеме. При этом вычисляют выход антибиотика. Для сравнения применяют контрольные образцы, выбранные из тех партий сырья, которые уже неоднократно зарекомендовали себя. Из этих контрольных образцов сырья приготавливают питательную среду, причем каждый раз один из ее компонентов заменяют исследуемым образцом. Контролем служит среда, составленная из одних контрольных образцов. Ферментация проводится в стеклянных колбах на качалках. Среды с испытуемыми образцами сырья не должны давать существенного снижения уровня активности антибиотика по сравнению со средой, составленной только из контрольных образцов. Опыты повторяют 2-3 раза. В каждый опыт обычно берут 3 колбы с испытуемым сырьем и 3 колбы с контрольным сырьем.
Таблица 14. Единицы действия различных антибиотиков

Важным фактором для успешного проведения биосинтеза антибиотиков является тщательная проверка качества питательной среды. На каждой стадии выращивания и в ходе самой ферментации необходимо проверить, не произошло ли заражения питательной среды чужеродными микроорганизмами.
Другим важным фактором является соблюдение оптимальных условий ферментации. В ходе проведения ферментации осуществляют микроскопическое наблюдение за состоянием культуры микроорганизма - продуцента. Так, например, в производстве пенициллина биологическим путем исследуют морфологию мицелия, процесс увеличения вакуолей и степень аутолиза.
Для определения степени аутолиза окрашивают цитоплазму раствором кротонового синего в присутствии молочной кислоты и фенола. Отсутствие посторонних микроорганизмов в культуральной жидкости является одним из основных условий биосинтеза антибиотиков. При этом большое значение имеет своевременное определение отсутствия заражения в посевном материале, передаваемом из посевных аппаратов в ферментеры. Контроль стерильности осуществляется в высеве в пробирки на питательный бульон и агар. Для выявления посторонней микрофлоры при данном методе требуется 24-48 ч, а выращивание посевного материала в посевных аппаратах производят в течение 2-3 сут. Не исключены случаи, когда заражение может быть обнаружено уже после использования посевного материала для засева ферментера. Контроль стерильности проводят обычным путем при помощи встряхивания пробирок, так как темп роста микроорганизмов при глубинном выращивании в этих условиях повышается.
При производстве антибиотиков необходимо контролировать также стерильность производственного процесса. В ходе ферментации контролируется отсутствие чужеродных микробов. При этом испытания проводят путем высева образца на питательную среду, пригодную для роста грибов: бульон, кровяной агар.
Концентрацию антибиотика в культуральной жидкости в процессе ферментации наряду с биологическими методами определяют и химическими методами. Химический анализ ферментационной среды необходимо провести в самом начале ферментации, еще перед засевом. В ходе самого процесса ферментации измеряют состав питательной среды: содержание Сахаров, общего, аминного и аммонийного азота. По разности между содержанием общего и растворенного азота судят об уровне мицелиального азота. Эта величина совместно с непосредственным определением сухой массы мицелия используется для информации о ходе роста микроорганизма-продуцента, а также о начале его аутолиза.
В технологическом процессе производства антибиотиков в стадиях ферментации и выделения очень важны измерение, регистрация и регулировка рН.
Величина рН и другие химические показатели могут указывать на плохое начало ферментации задолго до того, как это проявится впоследствии в низком уровне накопления антибиотика. Своевременный контроль дает возможность исправить многие ошибки и тем самым сохранить партию ферментации.
При выделении антибиотиков из культуральной жидкости необходимо обращать особое внимание на возможность потерь антибиотика.
Для контроля общей массы, объема раствора и т.д. аппаратура должна быть снабжена указателями или расходомерами. При экстракции антибиотика из нативного раствора органическими растворителями необходимо прежде всего контролировать рН водной фазы, из которой производится экстракция. При работе с ионообменными колонками контролируют ход сорбции и десорбции. Важно установить при сорбции, когда колонка будет насыщена. Контроль ведется путем определения содержания антибиотика в вытекающей из колонки жидкости.
При осаждении антибиотика из колонки надо контролировать соблюдение оптимальных условий: рН, температуру и т.д. Даже небольшое отклонение от оптимальных значений может привести к значительным потерям антибиотика за счет инактивации или неполного осаждения. Наконец, полученный готовый антибиотик подвергают химической и биологической проверке по всем показателям, указанным в Государственной фармакопее или в другой нормативно-технической документации.