





 Рейтинг: 4.3/5.0 (1566 проголосовавших)
Рейтинг: 4.3/5.0 (1566 проголосовавших)Категория: Инструкции
Вакцина «Менактра» - это препарат нового поколения. Известна немногим, так как создана сравнительно недавно (около 10 лет назад) американской компанией Sanofi Pasteur. Лекарство прошло ряд испытаний и имеет существенные отличия от аналогичных препаратов. Обладает рядом бактерий, влияющих на формирование иммунных показателей организма против возникновения менингита и заражения крови, вызванных менингококками.
СоставВакцина «Менактра» предупреждает ряд заболеваний, на появление которых влияют менингококки определенных серогрупп. Представляет собой слегка мутноватый прозрачный раствор для внутримышечного введения.
Одна доза, это около 0,5 мл, включает в себя такие действующие компоненты, как моновалентные менингококковые конъюгаты, состоящие из комбинации полисахарида определенных видов серогрупп (A, C, Y, W-135) и белка-носителя. Каждый отдельно взятый полисахарид конъюгирован с дифтерийным анатоксином, инъекционная дозировка которого равна 48 мкг.
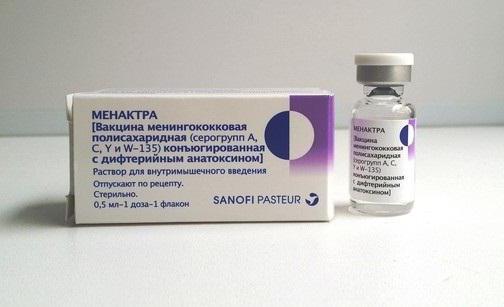
Дополнительными веществами в составе лекарственного средства выступают: натрия гидрофосфат, натрия хлорид, натрия дигидрофосфата моногидрат и специальная вода для инъекций.
Препарат упакован в стеклянные флаконы, содержащие единоразовую дозу - 0,5 мл. В картонной коробке может находиться один или пять флаконов, а также инструкция по применению.
Вакцину хранят при температурном режиме 2-8 °С. Её нельзя замораживать. Храниться она должна в прохладном месте, недоступном для детей. Если лекарство по какой-то причине было заморожено, то оно не подлежит дальнейшему использованию.
Срок годности препарата составляет два года с даты изготовления, указанной на упаковке.
«Менактру» производит известный во всем мире изготовитель вакцин "Санофи Пастёр Инкорпорейтед".
Вакцина «Менактра»: описание фармакологического действияКак правило, возбудителем менингококковых заболеваний (например, менингита) становится бактерия N. Meningitidis. Определен целый ряд серотипов этой группы бактерий. Использование вакцины «Менактра» провоцирует выработку характерных антител, направленных против возбудителя менингококковой инфекции. В вакцину входит четыре серогруппы, это А, С, Y и W-135. Все они наделены особой бактерицидной жизнедеятельностью.
Клинические испытания, направленные на получение результата от постановки "Менактры", не проводились, так как выделение сывороточных бактерицидных антител (СБА) является уровнем эффективности менингококковых вакцин.
Иммунологические качества рассматривали у детей от 2 до 10 лет и лиц в возрасте 11-55 лет. Иммуногенность определяли по показателю функциональности антител, которую выявляли с помощью бактерицидного анализа сыворотки. У лиц возрастной группы 2-10 лет иммунный ответ рассматривали перед разовой постановкой вакцины и по прошествии 28 суток. Было выявлено увеличение промежуточного геометрического титра (СГТ) бактерицидных антител. У всех типов серогрупп в 86-100% случаев при начальном неопределяемом показателе титров фиксировалась сероконверсия, характеризуемая как четрехкратное и более повышение титров антител по истечении 28 дней после прививки.

Зафиксирована способность «Менактры» влиять на иммунологическую память после первичной прививки у детей и взрослого населения.
Результаты испытаний у лиц 11-18 лет показали ту же иммунную реакцию на единовременное становление вакцины. Показатели СГТ СБА на 28-е сутки после прививки были намного выше исходных. В 98-100% случаев у подростков, при неопределении первоначального уровня антител, на 28-й день проявлялось черехкратное повышение титра СБА ко всем типам серогрупп в вакцине. Эти факты говорят о высокой иммуногенности лекарства у лиц указанного возраста.
У взрослых с неопределенными титрами антител в 93-100% случаев выявлено четырехкратное повышение титра СБА ко всем остальным видам серогрупп возбудителя в составе вакцины. Во всех испытаниях иммунологический ответ был одинаков вне зависимости от пола, возраста и расы.
Нет показателей о кинетике изначального ответа на становление вакцины, однако был зафиксирован иммунный ответ спустя 7-10 дней после прививки.
Длительность иммунной защиты после первичного становления вакцины доказана в результате клинических испытаний и равна трем годам после однократного введения препарата.
Показания к применениюВакцина «Менактра» предназначена для предупреждения менингококковой инфекции. На появление последней влияет бактерия N. Meningitidis с такими видами серогрупп, как A, C, Y и W-135, у людей самой разной возрастной категории.
Противопоказания к постановке прививки«Менактра» (вакцина) не должна применяться при непереносимости активных и дополнительных веществ в её составе. Запретом служат заболевания инфекционного и неинфекционного характера, а также период обострений хронических болезней.
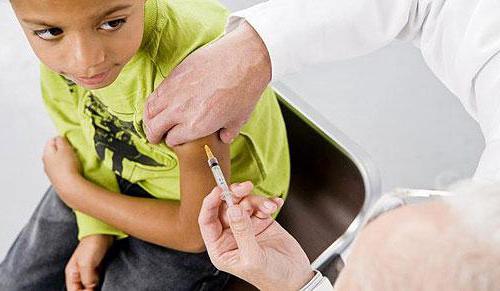
Дозировка и способ вакцинацииПрепарат «Менактра» (вакцина) инструкция советует вводить внутримышечно, желательно в район дельтовидной плечевой мышцы. Детям до года лекарство вводят в мышечную область бедра, так как у этой категории пациентов плечевые мышцы развиты слабо. Прививка делается единожды в дозировке 0,5 мл.

Перед становлением вакцины нужно соблюдать определенные меры безопасности, которые направлены на предупреждение нежелательных последствий. Анализируется состояние здоровья у человека, выяснятся наличие противопоказаний.
Вакцинация делается только медработником и под его контролем. Процедурный кабинет для подобных прививок должен быть оснащен препаратами для противошокового лечения.
В ряде случаев после введения инъекции наблюдались обморочные состояния. Медицинский работник, осуществляющий вакцинацию, должен быть готов к такому положению дел и своевременно предотвратить травму, связанную с падением, а также оказать необходимую медицинскую помощь.

Существует множество медицинских документов, определяющих, как должна применяться вакцина «Менактра». Схема вакцинации выглядит так:
Препарат дает надежную защиту от менингококковой инфекции, которая проявляется после десяти дней со дня прививки. Ревакцинация в этом случае не предусмотрена.
Взаимодействие с другими препаратамиЛекарство «Менактра» (живая вакцина) может вводиться в комплексе с полисахаридной прививкой, предупреждающей появление брюшного тифа. Сочетается с адсорбированной вакциной от столбняка и дифтерии. Совместное использование вышеперечисленных прививок допускается в возрастной категории 11-17 и 18-55 лет.
Нельзя ставить одновременно вакцину «Менактра» и прививку БЦЖ.
Если две вакцинации проводятся одновременно, то их необходимо делать в разные участки тела. Для каждого укола используют отдельный шприц.
Беременность и лактацияВ результате продолжительных клинических испытаний было выявлено, что не оказывает негативного влияния на беременность и плод вакцина «Менактра». Описание препарата, несмотря на это, рекомендует применять его в этот период в том случае, если потенциальная польза для матери превышает риск для развития плода. Например, допустимо её применение, если заболевания менингококковой инфекцией носят массовый характер, при эпидемии или поездке в эндемичный район.
Не изучалась способность активных компонентов этой вакцины проникать в грудное молоко кормящей женщины. В ранних испытаниях подобных вакцин антитела к полисахаридам обнаруживали у молодых мышей, которых ещё кормила мать. Этот факт никак не повлиял на развитие потомства. Подобные исследования на людях не проводились.
Перед тем как вакцинировать женщину в период лактации, необходимо тщательно взвесить все риски и оценить возможную пользу от прививки.
Вакцина «Менактра»: побочные явленияПосле вакцинации этим препаратом многих пациентов беспокоили различные негативные реакции. Симптоматика различалась в зависимости от возрастной принадлежности.
Так, у лиц от двух до десяти лет были отмечены болезненность, уплотнение, отек и покраснение зоны введения препарата. Дети после прививки были разражены, наблюдалась сонливость. В некоторых случаях возникали анорексия, диарея, рвота и лихорадка. Беспокоили малышей сыпь и крапивница. Были проявления в виде артралгии.

У подростков 11-18 лет и взрослых людей в возрасте 18-55 лет появлялись болезненность и уплотнение в области введения прививки. Беспокоили головные боли, диарея, рвота. Возникала повышенная утомляемость. Снижался аппетит. Была замечена сыпь, артралгия. Наблюдался озноб, недомогание общего характера, лихорадка.
Возникали различные реакции гиперчувствительности. Был зафиксирован синдром Гийена-Барре, частичная потеря памяти, судороги, паралич лицевого нерва, парестезия, поперечный миелит, головокружение, рассеянный энцефаломиелит в острой форме, миалгия.
Вакцина менингококковой инфекции «Менактра» может вызвать ряд недомоганий, но все они проходят в легкой форме и исчезают в течение недели после прививки.
Особые указанияВакцина менингита «Менактра» рекомендуется людям с повышенным риском заразиться менингококковой инфекцией. Это лица, которые имели непосредственный контакт с больными, инфицированными менингококками. Должны сделать эту прививку люди, имеющие дефицит пропердина, а также компонентов комплемента. Вакцина просто жизненно необходима гражданам с аспленией. Ее также ставят людям, выезжающим в гиперэндемичные районы, и сотрудникам лабораторий, регулярно проводящим различные исследования по воздействию бактерии N. Meningitidis. Врачи советуют делать эту прививку студентам, проживающим в общежитии, и призывникам.
Препарат нельзя вводить в вену, внутри- или подкожно. Данные о возможных последствиях при такой инсталляции лекарства отсутствуют.
Запрещается соединять эту вакцину в одном шприце с другими лекарственными средствами.
Не изучалось воздействие прививки на больных тромбоцитопенией или людей, страдающих нарушениями свертываемости крови. Здесь имеется риск возникновения кровотечения при внутримышечном введении. В случае постановки прививки таким лицам следует взвесить потенциальный риск и пользу.
Аналогичная картина наблюдается и при синдроме Гийена-Барре. Возникали случаи прогрессирования болезни после введения вакцины. Поэтому перед вакцинацией лица, страдающие синдромом Гийена-Барре, необходимо тщательно оценить всевозможные риски.
Препарат не предупреждает менингиты, спровоцированные другими микроорганизмами и бактериями, а также заболевания, вызванные менингококковой инфекцией серогруппы В.
У людей с ослабленным иммунитетов и у лиц с иммуносупрессивным лечением зачастую наблюдается пониженная иммунная реакция на становление прививки «Менактра». Защитный иммунный ответ может вырабатываться не у всех пациентов одинаково на 100%.
Перед предстоящей вакцинацией медработник или лечащий врач должен информировать пациентов о вреде или пользе от введенной прививки, а также о возможных побочных явлениях.
Отзывы о вакцинацииОтличается высокой химической чистотой, определяет стойкую и длительную иммунную защиту и мультивалентность «Менактра» (вакцина). Отзывы об этой прививке в основном положительные.
Многие мамы ставят вакцину своим детям как в раннем возрасте, так и в более позднем. Говорят, что она переносится хорошо и редко вызывает негативные реакции. У некоторых малышей в первые дни после прививки наблюдалось повышение температуры тела от 37,2 до 40 °С. Беспокоила чрезмерная раздражительность, снижался аппетит. Врачи в ответ на волнения мам по этому поводу говорили, что это норма, и именно так должен формироваться иммунный ответ на введенную вакцину. К счастью, подобные явления носили непродолжительный характер, и мамы вскоре переставали тревожиться за состояние своего ребенка.

Также врачи советуют перед прививкой давать «Фенистил» или другие препараты от аллергии. Взрослые люди обычно переносят ее хорошо, без негативных последствий.
Некоторые люди не понимают, зачем делать такие прививки без предписания врача. Отмечают, что тем, кто живет в России, она вряд ли пригодится, так как большинство людей, заболевших менингитом, приобрели эту болезнь не из-за менингококковых серогрупп A, C, Y, W-135, а из-за перенесенных недугов. Утверждают, что самую тяжелую форму менингита вызывает менингококковая серогруппа В, а от неё на сегодняшний день нет вакцины.
Несмотря на разногласия, многие люди ставят вакцину «Менакра» себе и своим детям. Негативные последствия от неё развиваются крайне редко, зато она защищает человека от менингококковых инфекций на протяжении всей жизни. Этот факт подтверждают тысячи спасенных во всем мире людей.
Тема для тех, кто прививается или собирается прививаться. Вакцинация - дело деликатное и сугубо индивидуальное, поэтому без некоторых специальных познаний в этой области нам не обойтись. Тем более, что вся подготовка к прививке и ведение ребёнка после неё - на наших родительских плечах. Давайте быть достойными партнёрами для педиатров!
Добавлено (28.04.2010, 21:08)
---------------------------------------------
1.Национальный календарь прививок можно посмотреть здесь:
http://www.privivka.ru/ru/vaccination/about/calendar/
Но тезис об индивидуальности вакцинации он не отменяет. Просто помогает правильно рассчитывать сроки повторных вакцинаций и ревакцинаций. То есть Вы можете начать прививаться, например, АКДС и в полгода, и в год - интервалы останутся прежними - повторные вакцинации через 1.5 месяца - это если не будет мед. отвода.
4.По СП 3.3.2342-08 допускается проведение вакцинации "своими" вакцинами, но в прививочном кабинете поликлиники. При условии:
3.16. Самостоятельно приобретенные в аптечном учреждении по рецепту врача МИБП переносятся пациентом в термоконтейнере с хладоэлементами или в термосе со льдом для обеспечения соблюдения должного температурного режима. МИБП рекомендуется использовать в возможно короткие сроки (как правило, не более 48 часов с момента отпуска).
5. Про "не мочить прививку".
Ноги у этого мифа растут из старых проб на туберкулёз (может, кто помнит Пирке?) - НАКОЖНЫХ. Вот их и правда нельзя было мочить. Сейчас и пробы-то ВНУТРИКОЖНЫЕ, а уж прививки и вовсе ВНУТРИМЫШЕЧНО делают. Ну вдумайтесь: приходится вакцину через иглу заводить! А вода что, самотёком проникнет в мышцу?
Мочите прививки сколько душе угодно, это не влияет на инфильтратик в мышце после АКДС. Пройдёт.
6. Планируем прививку после инфекции:
Методические указания МУ 3.3.1.1095-02
3.3.1. Вакцинопрофилактика "Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок"(утв. Главным государственным санитарным врачом РФ от 9 января 2002 г.)
Таблица 1. Перечень медицинских противопоказаний к проведению профилактических прививок*
Примечания
* Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Плановые прививки проводятся через 2 - 4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых ОРВИ, острых кишечных заболеваниях и др. прививки проводятся сразу после нормализации температуры.
7. Вакцинация и проба Манту.
После вакцинации пробу Манту можно делать не ранее, чем через месяц (от живых вакцин - 6 недель).
Если сначала выполняется проба Манту - то прививаться можно уже в день проверки результата пробы.
Вдруг кому пригодится.
Мы решили привить детей вакциной Менактра. (Опуская подробности) На приеме нам отказали в вакцинации(вернее дочь заболела ,а сыну перенесли т.к. нужно было разобраться с инструкцией ,а времени на это не было сами понимаете прививочный день -народу куча). Что смутило нашего врача(и меня если честно тоже) в инструкции к этой вакцине указано: Вакцина менингококковая полисахаридная серогрупп A, C, Y и W -135 конъюгированная дифтерийным анатоксином
Для какой цели там дифтерийный анатоксин. Резонный вопрос врача и прививочный медсестры. Если ребенок привит от дифтерии ему нельзя получается прививаться этой вакциной(логичный вывод). Решили не рисковать и отложить вакцинацию и все выяснить.
Я задала вопрос на Русмедсервере,и там успокоили ,что анатоксин в данной вакцине лишь для связи белков и не влияет на иммунитет от дифтерии. Меня это несколько успокоило,но для врача я сделала запрос в фирму изготовитель. И вот сегодня пришел ответ на почту :
Вакцина Менактра представляет собой раствор очищенных капсульных полисахаридов Neisseria meningitidis серогрупп A, C, Y и W, индивидуально конъюгированных с белком-носителем (очищенным дифтерийным анатоксином). Дифтерийный анатоксин получают из дифтерийного токсина путем трехступенчатой инактивации формальдегидом. Очищенный дифтерийный анатоксин, не имеющий токсических свойств, далее используют в качестве белка-носителя для химической конъюгации с капсульными полисахаридами Neisseria meningitidis серогрупп A, C, Y и W. Содержание дифтерийного анатоксина в прививочной дозе составляет около 48 мкг. Иммунизация лиц вакциной Менактра, содержащей в своем составе дифтерийный анатоксин в качестве белка-носителя, не защищает привитых лиц от дифтерии и тем самым не заменяет собой иммунизацию против дифтерии тех лиц, которым данная иммунизация показана.
Т.к. вакцина достаточно редко встречающаяся пока еще у нас в городе. Вполне возможно ,что кто-то опять окажется в такой же ситуации что и мы. Поэтому лучше идти заранее подготовленными))) 
Сообщение отредактировал Svetlaya - Вторник, 29.12.2015, 00:43
Вакцинация проводится однократно в дозе 0,5 мл.
Вакцину следует вводить внутримышечно, предпочтительно в дельтовидную мышцу плеча.
Меры предосторожности при примененеии
Перед введением вакцины необходимо принять необходимые меры предосторожности, направленные на профилактику тяжелых побочных реакций, которые включают изучение прививочного анамнеза пациента, выяснение наличия противопоказаний к иммунизации и оценку текущего состояния здоровья пациента.
Введение вакцины проводится под контролем медицинского работника, а в кабинете, где проводят вакцинацию, должен быть доступны необходимые средства противошоковой терапии (например, растворы эпинефрина гидрохлорида (1:1000) и глюкокортикостероидов для инъекции).
После введения вакцины Менактра отмечались случаи обморока. Необходимо предусмотреть меры для предотвращения травм, связанных с падением в обморок, а также медицинскую помощь в связи с обмороком.
Характер и частота выявленных в исследованиях побочных эффектов различались в зависимости от возраста прививаемых. В ходе клинических исследований у детей в возрасте от 2 до 10 лет наиболее часто отмечались болезненность и покраснение в месте инъекции, раздражительность, диарея, сонливость, анорексия; у подростков в возрасте от 11 до 18 лет и у взрослых лиц от 18 до 55 лет наиболее часто отмечались болезненность в месте инъекции, головная боль и повышенная утомляемость. Частота развития приведенных ниже побочных эффектов классифицирована согласно рекомендациям Всемирной организации здравоохранения (ВОЗ) и включает следующие категории: очень часто: ≥ 10 %; часто: ≥ 1 % и < 10%; нечасто: ≥ 0,1 % и < 1 %; редко: ≥ 0,01 % и < 0,1 %; очень редко: < 0,01%; частота неизвестна: не может быть определена согласно имеющимся данным.
Дети в возрасте от 2 до 10 лет
Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими. Кроме этого, отмечены следующие нарушения:
Со стороны обмена веществ и питания
Очень часто или часто: снижение аппетита
Со стороны нервной системы
Очень часто или часто: сонливость
Очень часто: диарея
Со стороны кожи и подкожных тканей
Часто: сыпь, крапивница
Со стороны скелетно-мышечной и соединительной ткани
Общие расстройства и нарушения в месте введения
Очень часто: болезненность и уплотнение в месте инъекции
Очень часто или часто: раздражительность, покраснение в месте инъекции, отек в месте инъекции, лихорадка
Лица в возрасте 11-55 лет
Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими. Кроме этого, отмечены следующие нарушения:
Со стороны обмена веществ и питания
Очень часто или часто: снижение аппетита
Со стороны нервной системы
Очень часто: головная боль
Очень часто или часто: диарея
Со стороны кожи и подкожных тканей
Со стороны скелетно-мышечной и соединительной ткани
Очень часто: артралгия
Общие расстройства и нарушения в месте введения
Очень часто: боль, уплотнение, покраснение и отек в месте инъекции, повышенная утомляемость, общее недомогание
Часто: озноб, лихорадка
В постмаркстинговый период дополнительно получена информация о следующих нежелательных явлениях после введения препарата (в настоящее время частота развития данных явлений и их причинно-следственная связь с применением вакцины Менактра не может быть определена):
Со стороны иммунной системы
Реакции гиперчувствительности, такие как анафилактический шок, анафилактоидные реакции, стридорозное дыхание, затруднение при дыхании, отек верхних дыхательных путей, крапивница, покраснение кожи, кожный зуд. снижение артериального давления.
Со стороны нервной системы
Синдром Гийена-Барре (СГБ). парестезии, потеря сознания (обусловленная нарушениями регуляции со стороны вегетативной нервной системы), головокружение, судороги, паралич лицевого нерва, острый рассеянный энцефаломиелит, поперечный миелит.
Со стороны скелетно-мышечной и соединительной ткани
Риск СГБ после введения вакцины Менактра оценивался в рамках проводившегося в США ретроспективного когортного исследования, в котором использовалась электронная база данных медицинского обслуживания 9 578 688 пациентов в возрасте 11-18 лет, из которых 1 431 906 (15%) получили вакцину Менактра. Ни один из пациентов, описанных в 72 сообщениях о медицински подтвержденных случаях СГБ, не получил вакцину Менактра в течение 42 дней до начала развития симптомов. Еще 129 потенциальных случаев СГБ не были медицински подтверждены или были исключены из анализа вследствие отсутствия или недостаточности медицинской информации. В рамках анализа, учитывавшего отсутствовавшие данные, оцененный дополнительный риск СГБ варьировал от 0 до 5 дополнительных случаев СГБ на 1 000 000 привитых в течение 6 недель после вакцинации.
Противопоказания к применению
— известная гиперчувствительность с системными проявлениями к любому компоненту вакцины, включая дифтерийный анатоксин, или на предыдущее введение других вакцин, включающих те же компоненты;
— острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний (в этих случаях вакцинацию проводят после выздоровления или в стадии ремиссии).
Применение при беременности и кормлении грудью
Исследования на животных не выявили отрицательного действия вакцины Менактра на течение беременности и фето-эмбрионального развития плода, процесс родов и постнатальное развитие. В связи с тем, что исследований вакцины у беременных женщин не проводилось, а постмаркетинговый опыт ее применения ограничен, введение вакцины беременным женщинам рекомендуется только в случае крайней необходимости, как например, во время вспышки менингококковой инфекции, перед поездкой в эндемичный район, и только после оценки соотношения пользы и риска вакцинации. В настоящее время неизвестно, способны ли активные вещества, входящие в состав вакцины, проникать в грудное молоко. Однако ранее было показано, что антитела к полисахаридам обнаруживаются у молодых мышей, находившихся на грудном вскармливании.
В исследованиях на мышах не было продемонстрировано неблагоприятного влияния на постнатальное развитие потомства, получавшего материнские антитела с молоком и выработка которых была индуцирована введением вакцины Менактра. В то же время, эффекты у детей первого года жизни, матери которых были иммунизированы вакциной Менактра в период грудного вскармливания, не исследовались. Перед принятием решения об иммунизации кормящей женщины, необходимо оценить риски и пользу данной иммунизации.
Применение у детей
Вакцинации подлежат дети достигшие 2 летнего возраста.
Вакцинация особенно показана следующим группам с высоким риском заболевания менингококковой инфекцией:
- лицам, которые имели непосредственный контакт с пациентами, инфицированными менингококками серогрупп А, С, Y или W-135 (в семье или в учреждениях закрытого типа);
- лицам с дефицитом пропердина и компонентов комплемента;
- лицам с функциональной или анатомической аспленией;
- туристам и лицам, выезжающим в гиперэндемичные по менингококковой инфекции зоны, такие как страны Африки, расположенные к югу от Сахары;
- сотрудникам исследовательских, промышленных и клинических лабораторий, регулярно подвергающиеся воздействию N. meningitidis, находящейся в растворах, способных образовывать аэрозоль;
- студентам различных вузов, и, особенно, проживающих в общежитиях или в гостиницах квартирного типа;
- призывникам и новобранцам.
Запрещено вводить вакцину Менактра внутривенно, подкожно или внутрикожно, поскольку данные о безопасности и эффективности вакцины при подкожном, внутривенном и внутрикожном введении отсутствуют.
Запрещается смешивать вакцину Менактра в одном шприце с другими вакцинами или препаратами.
Применение вакцины у лиц с тромбоцитопенией или нарушениями свертываемости крови не изучалось. Как и в случае других вакцин, вводимых внутримышечно, следует оценить соотношение пользы и риска применения вакцины у лиц с повышенным риском развития кровотечения при внутримышечной инъекции.
Риск развития синдрома Гийена-Барре (СГБ) после вакцинации Менактрой оценивался в рамках постмаркетингового ретроспективного когортного исследования. Описаны случаи развития СГБ, характеризовавшиеся наличием связи по времени с введением вакцины Менактра. Лица, которым ранее был установлен диагноз СГБ, могут составлять группу повышенного риска развития данного состояния после введения вакцины Менактра. Решение об использовании вакцины Менактра в данной ситуации должно приниматься после оценки потенциальных пользы и рисков.
Вакцина не предназначена для профилактики менингитов, вызванных другими микроорганизмами или для профилактики инвазивной менингококковой инфекции, вызванной менингококками серогруппы В.
У лиц с нарушенным иммунным статусом, а также на фоне иммуносупрсссивной терапии, может наблюдаться сниженный иммунный ответ на введение вакцины Менактра.
Как при любой вакцинации, защитный иммунитет может вырабатываться не у всех 100% привитых.
Перед применением вакцины медицинский работник или лечащий врач должен информировать пациента, его родителей, опекунов или других ответственных взрослых лиц о возможной пользе и риске для пациента, связанных с введением вакцины.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований по изучению влияния вакцины на способность к управлению автомобилем и другими механизмами не проводилось.
Другие лекарства фармгруппы
Москва, Россия – 6 октября 2014 г. – Санофи Пастер, подразделение вакцин Группы Санофи (EURONEXT: SAN и NYSE: SNY), сегодня объявила о регистрации в России первой конъюгированной менингококковой вакцины Менактра.
Четырехвалентная менингококковая конъюгированная вакцина Менактра - это первая менингококковая вакцина в мире, применение которой позволяет иммунизировать детей с целью формирования длительного иммунитета против менингококковой инфекции. Эта вакцина направлена на борьбу с четырьмя из пяти наиболее распространенных серотипов A, C, Y, W, вызывающих тяжелые формы менингококковой инфекции. В России вакцина Менактра разрешена к применению у детей с 2 лет и взрослых до 55 лет.
До настоящего момента на Российском рынке присутствовали только полисахаридные менингококковые вакцины. В отличие от полисахаридных вакцин конъюгированные менингококковые вакцины обеспечивают формирование иммунологической памяти, т.е. более длительной защиты от менингококковой инфекции у привитых.
«На текущий момент национальный календарь прививок в России предписывает вакцинацию против менингококковой инфекции по эпидемическим показаниям, т.е. только после возникновения вспышки заболевания. Отсутствие плановой профилактики тяжелых форм менингококковой инфекции в России, на наш взгляд, было обусловлено отсутствием вакцин, показанных для длительной защиты. Благодаря преимуществу конъюгированных вакцин вакцина Менактра может применяться не только во время вспышек менингококковых заболеваний, но и для плановой профилактики. Мы рады, что Россия вошла в число стран, в которых доступна более совершенная и эффективная вакцина против такой тяжелой инфекции как менингококковая», сказал Генеральный директор Санофи Пастер в России Тибо Кроснье Леконт.
Менактра, первая в мире четырехвалентная менингококковая конъюгированная вакцина, была разработана и лицензирована в США в 2005 году. С 2005 по 2013 год было произведено более 71 млн. доз этой вакцины. Россия стала 53-й страной, зарегистрировавшей вакцину.
Эпидемиология и заболеваемость:
К тяжелым формам менингококковой инфекции относятся менингококковый менингит и менингококковый сепсис – тяжелые заболевания со стремительным прогрессированием и летальным исходом у каждого шестого заболевшего ребенка (летальность в России у детей до 17 лет - 16,4% в 2013 году). Необратимые последствия менингококковых менингитов (потеря слуха, зрения, ампутация конечностей, неврологические нарушения) развиваются в 10-15% случаев.
В России тяжелые формы менингококковой инфекции особенно опасны для детей: по данным Роспотребнадзора РФ заболеваемость детей до 17 лет (2,99 на 100 тыс.) превышает заболеваемость у взрослых в четыре раза (0,79 на 100 тыс.), среди заболевших более 83% - это дети первых пяти лет жизни.*
Справка о заболевании:
Возбудителем менингококковой инфекции является бактерия Neisseria meningitidis. Единственным носителем бактерии является человек. Инфекция распространяется воздушно-капельным путем и носит характер спорадических случаев и вспышек. Заболевают преимущественно дети, а также лица молодого возраста, чаще в закрытых коллективах.
Справка о компании:
Санофи Пастер, подразделение Группы Санофи, – крупнейший производитель вакцин. Ежегодно компания выпускает более 1 млрд. доз вакцин для иммунизации более чем 500 млн. человек по всему миру. Являясь мировым лидером в области разработки и производства вакцин, Санофи Пастер предлагает широкий портфель иммунопрепаратов для профилактики 19 инфекционных заболеваний. На протяжении более чем 100-летней истории, миссия компании остается неизменной и направлена на сохранение жизни и защиту здоровья человека от инфекционных заболеваний. Каждый день Санофи Пастер инвестирует в исследования и разработку более 1 млн. евро.
Контакты со СМИ:
Виктория Ерёмина, директор по коммуникациям Санофи Евразия
Наталья Петриченко, менеджер по коммуникациям Санофи Евразия
*Решение коллегии Федеральной службы по надзору в сфере защиты прав потребителей и благополучия «Актуальные вопросы эпидемиологического надзора и профилактики бактериальных менингитов в Российской Федерации» от 26.06.2014
Сравнить цены на Новости компании и заказать:
Описание и инструкция: к "ВАКЦИНА МЕНАКТРА. р-р д/ин в/м 0,5мл/доза фл №1"
Форма выпуска, состав.
Раствор для в/м введения бесцветный, прозрачный или слегка мутноватый.
1 доза (0.5 мл)
моновалентные менингококковые конъюгаты полисахаридов Neisseria meningitidis серогруппы A* 4 мкг
моновалентные менингококковые конъюгаты полисахаридов Neisseria meningitidis серогруппы C* 4 мкг
моновалентные менингококковые конъюгаты полисахаридов Neisseria meningitidis серогруппы Y* 4 мкг
моновалентные менингококковые конъюгаты полисахаридов Neisseria meningitidis серогруппы W-135* 4 мкг
*каждый полисахарид конъюгирован с дифтерийным анатоксином. Содержание белка дифтерийного анатоксина в прививочной дозе составляет около 48 мкг.
Вспомогательные вещества. натрия хлорид - 4.35 мг, натрия гидрофосфат - 0.348 мг, натрия дигидрофосфата моногидрат - 0.352 мг, вода д/и - до 0.5 мл.
Клинико-фармакологическая группа: вакцина для профилактики заболеваний, вызванных менингококками
Фармако-терапевтическая группа: МИБП-вакцина
Фармакологическое действие.
Показания:
— профилактика инвазивной менингококковой инфекции, вызываемой N. meningitidis серогрупп А, С, Y и W-135 у лиц в возрасте от 2 лет до 55 лет.
Режим дозирования.
Вакцинация проводится однократно в дозе 0,5 мл.
Вакцину следует вводить внутримышечно, предпочтительно в дельтовидную мышцу плеча.
Меры предосторожности.
Перед введением вакцины необходимо принять необходимые меры предосторожности, направленные на профилактику тяжелых побочных реакций, которые включают изучение прививочного анамнеза пациента, выяснение наличия противопоказаний к иммунизации и оценку текущего состояния здоровья пациента.
Введение вакцины проводится под контролем медицинского работника, а в кабинете, где проводят вакцинацию, должен быть доступны необходимые средства противошоковой терапии (например, растворы эпинефрина гидрохлорида (1:1000) и глюкокортикостероидов для инъекции).
После введения вакцины Менактра отмечались случаи обморока. Необходимо предусмотреть меры для предотвращения травм, связанных с падением в обморок, а также медицинскую помощь в связи с обмороком.
Побочное действие
Характер и частота выявленных в исследованиях побочных эффектов различались в зависимости от возраста прививаемых. В ходе клинических исследований у детей в возрасте от 2 до 10 лет наиболее часто отмечались болезненность и покраснение в месте инъекции, раздражительность, диарея, сонливость, анорексия; у подростков в возрасте от 11 до 18 лет и у взрослых лиц от 18 до 55 лет наиболее часто отмечались болезненность в месте инъекции, головная боль и повышенная утомляемость. Частота развития приведенных ниже побочных эффектов классифицирована согласно рекомендациям Всемирной организации здравоохранения (ВОЗ) и включает следующие категории: очень часто: ≥ 10 %; часто: ≥ 1 % и < 10%; нечасто: ≥ 0,1 % и < 1 %; редко: ≥ 0,01 % и < 0,1 %; очень редко: < 0,01%; частота неизвестна: не может быть определена согласно имеющимся данным.
Дети в возрасте от 2 до 10 лет.
Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими. Кроме этого, отмечены следующие нарушения:
Со стороны обмена веществ и питания
Очень часто или часто: снижение аппетита
Со стороны нервной системы
Очень часто или часто: сонливость
Со стороны ЖКТ
Очень часто: диарея
Часто: рвота
Со стороны кожи и подкожных тканей
Часто: сыпь, крапивница
Со стороны скелетно-мышечной и соединительной ткани
Часто: артралгия
Общие расстройства и нарушения в месте введения
Очень часто: болезненность и уплотнение в месте инъекции
Очень часто или часто: раздражительность, покраснение в месте инъекции, отек в месте инъекции, лихорадка
Лица в возрасте 11-55 лет.
Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими. Кроме этого, отмечены следующие нарушения:
Со стороны обмена веществ и питания
Очень часто или часто: снижение аппетита
Со стороны нервной системы
Очень часто: головная боль
Со стороны ЖКТ
Очень часто или часто: диарея
Часто: рвота
Со стороны кожи и подкожных тканей
Часто: сыпь
Со стороны скелетно-мышечной и соединительной ткани
Очень часто: артралгия
Общие расстройства и нарушения в месте введения
Очень часто: боль, уплотнение, покраснение и отек в месте инъекции, повышенная утомляемость, общее недомогание
Часто: озноб, лихорадка
Со стороны иммунной системы.
Реакции гиперчувствительности, такие как анафилактический шок, анафилактоидные реакции, стридорозное дыхание, затруднение при дыхании, отек верхних дыхательных путей, крапивница, покраснение кожи, кожный зуд. снижение артериального давления.
Со стороны нервной системы.
Синдром Гийена-Барре (СГБ). парестезии, потеря сознания (обусловленная нарушениями регуляции со стороны вегетативной нервной системы), головокружение, судороги, паралич лицевого нерва, острый рассеянный энцефаломиелит, поперечный миелит.
Со стороны скелетно-мышечной и соединительной ткани.
Миалгия
Противопоказания к применению:
— известная гиперчувствительность с системными проявлениями к любому компоненту вакцины, включая дифтерийный анатоксин, или на предыдущее введение других вакцин, включающих те же компоненты;
— острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний (в этих случаях вакцинацию проводят после выздоровления или в стадии ремиссии).
Применение при беременности и кормлении грудью.
Исследования на животных не выявили отрицательного действия вакцины Менактра на течение беременности и фето-эмбрионального развития плода, процесс родов и постнатальное развитие. В связи с тем, что исследований вакцины у беременных женщин не проводилось, а постмаркетинговый опыт ее применения ограничен, введение вакцины беременным женщинам рекомендуется только в случае крайней необходимости, как например, во время вспышки менингококковой инфекции, перед поездкой в эндемичный район, и только после оценки соотношения пользы и риска вакцинации. В настоящее время неизвестно, способны ли активные вещества, входящие в состав вакцины, проникать в грудное молоко. Однако ранее было показано, что антитела к полисахаридам обнаруживаются у молодых мышей, находившихся на грудном вскармливании.
В исследованиях на мышах не было продемонстрировано неблагоприятного влияния на постнатальное развитие потомства, получавшего материнские антитела с молоком и выработка которых была индуцирована введением вакцины Менактра. В то же время, эффекты у детей первого года жизни, матери которых были иммунизированы вакциной Менактра в период грудного вскармливания, не исследовались. Перед принятием решения об иммунизации кормящей женщины, необходимо оценить риски и пользу данной иммунизации.
Применение у детей.
Вакцинации подлежат дети достигшие 2 летнего возраста.
Особые указания.
Вакцинация особенно показана следующим группам с высоким риском заболевания менингококковой инфекцией:
- лицам, которые имели непосредственный контакт с пациентами, инфицированными менингококками серогрупп А, С, Y или W-135 (в семье или в учреждениях закрытого типа);
- лицам с дефицитом пропердина и компонентов комплемента;
- лицам с функциональной или анатомической аспленией;
- туристам и лицам, выезжающим в гиперэндемичные по менингококковой инфекции зоны, такие как страны Африки, расположенные к югу от Сахары;
- сотрудникам исследовательских, промышленных и клинических лабораторий, регулярно подвергающиеся воздействию N. meningitidis, находящейся в растворах, способных образовывать аэрозоль;
- студентам различных вузов, и, особенно, проживающих в общежитиях или в гостиницах квартирного типа;
- призывникам и новобранцам.
Запрещено вводить вакцину Менактра внутривенно. подкожно или внутрикожно, поскольку данные о безопасности и эффективности вакцины при подкожном, внутривенном и внутрикожном введении отсутствуют.
Запрещается смешивать вакцину Менактра в одном шприце с другими вакцинами или препаратами.
Применение вакцины у лиц с тромбоцитопенией или нарушениями свертываемости крови не изучалось. Как и в случае других вакцин, вводимых внутримышечно, следует оценить соотношение пользы и риска применения вакцины у лиц с повышенным риском развития кровотечения при внутримышечной инъекции.
Риск развития синдрома Гийена-Барре (СГБ) после вакцинации Менактрой оценивался в рамках постмаркетингового ретроспективного когортного исследования. Описаны случаи развития СГБ, характеризовавшиеся наличием связи по времени с введением вакцины Менактра. Лица, которым ранее был установлен диагноз СГБ, могут составлять группу повышенного риска развития данного состояния после введения вакцины Менактра. Решение об использовании вакцины Менактра в данной ситуации должно приниматься после оценки потенциальных пользы и рисков.
Вакцина не предназначена для профилактики менингитов. вызванных другими микроорганизмами или для профилактики инвазивной менингококковой инфекции, вызванной менингококками серогруппы В.
У лиц с нарушенным иммунным статусом. а также на фоне иммуносупрсссивной терапии, может наблюдаться сниженный иммунный ответ на введение вакцины Менактра.
Как при любой вакцинации, защитный иммунитет может вырабатываться не у всех 100% привитых.
Перед применением вакцины медицинский работник или лечащий врач должен информировать пациента, его родителей, опекунов или других ответственных взрослых лиц о возможной пользе и риске для пациента, связанных с введением вакцины.
Влияние на способность к вождению автотранспорта и управлению механизмами.
Исследований по изучению влияния вакцины на способность к управлению автомобилем и другими механизмами не проводилось.
Передозировка.
Нет достоверных данных.
Лекарственное взаимодействие.
Вакцину Менактра применяли одновременно с полисахаридной вакциной для профилактики брюшного тифа и с адсорбированной вакциной, содержащей столбнячный и дифтерийный анатоксины, предназначенной для использования у взрослых (Td), у лиц в возрасте 18-55 лет и 11-17 лет, соответственно.
БЦЖ вакцина не должна применяться одновременно с вакциной Менактра.
Вводить вакцины необходимо всегда в разные участки тела, используя отдельные шприцы для каждой из них.
Условия отпуска из аптек.
По рецепту.
Условия и сроки хранения.
При температуре от 2 до 8°С. Не замораживать. Хранить в недоступном для детей месте. Препарат, подвергшийся замораживанию, использованию не подлежит.
Срок годности - 2 года.
Отзывы о препарате: ВАКЦИНА МЕНАКТРА, р-р д/ин в/м 0,5мл/доза фл №1