







 Рейтинг: 4.6/5.0 (1599 проголосовавших)
Рейтинг: 4.6/5.0 (1599 проголосовавших)Категория: Инструкции
 Вы увлекаетесь цветоводством и пришли в магазин, чтобы купить удобрения для своих цветов. Пересматривая различные названия и составы, вы заметили бутыль с надписью "Азотное удобрение". Читаем его состав: "Фосфор, кальций, то-се. Азотная кислота? А это еще что за зверь?!". Обычно с азотной кислотой знакомятся именно в такой обстановке. И многим тогда же захочется узнать о ней побольше. Сегодня я постараюсь удовлетворить ваше любопытство.
Вы увлекаетесь цветоводством и пришли в магазин, чтобы купить удобрения для своих цветов. Пересматривая различные названия и составы, вы заметили бутыль с надписью "Азотное удобрение". Читаем его состав: "Фосфор, кальций, то-се. Азотная кислота? А это еще что за зверь?!". Обычно с азотной кислотой знакомятся именно в такой обстановке. И многим тогда же захочется узнать о ней побольше. Сегодня я постараюсь удовлетворить ваше любопытство.
Азотная кислота (формула HNO3 ) является сильной одноосновной кислотой. В неокисленном состоянии она выглядит так, как на фото 1. В обычных условиях это жидкость, но ее можно перевести в твердое агрегатное состояние. И в нем она напоминает кристаллы, имеющие моноклинную или ромбическую решетку.
Химические свойства азотной кислоты
 Имеет способность хорошо смешиваться с водой, где происходит почти полная диссоциация этой кислоты на ионы. Концентрированная азотная кислота имеет бурый цвет (фото). Его обеспечивает разложение на диоксид азота, воду и кислород, происходящее из-за солнечного света, который падает на нее. Если ее нагреть, произойдет такое же разложение. С ней реагируют все металлы, за исключением тантала, золота и платиноидов (рутения, родия, палладия, иридия, осмия и платины). Однако ее соединение с соляной кислотой может даже растворять некоторые из них (это так называемая "царская водка"). Азотная кислота, имеющая любую концентрацию, может проявляться в качестве окислителя. Многие органические вещества при взаимодействии с ней могут самовоспламеняться. А некоторые металлы в этой кислоте будут пассивироваться. При действии на них (а также при реакции с оксидами, карбонатами и гидроксидами) азотная кислота образует свои соли, носящие название нитратов. Последние хорошо растворяются в воде. Но нитрат-ионы в ней не гидролизуются. Если нагреть соли данной кислоты, то произойдет их необратимое разложение.
Имеет способность хорошо смешиваться с водой, где происходит почти полная диссоциация этой кислоты на ионы. Концентрированная азотная кислота имеет бурый цвет (фото). Его обеспечивает разложение на диоксид азота, воду и кислород, происходящее из-за солнечного света, который падает на нее. Если ее нагреть, произойдет такое же разложение. С ней реагируют все металлы, за исключением тантала, золота и платиноидов (рутения, родия, палладия, иридия, осмия и платины). Однако ее соединение с соляной кислотой может даже растворять некоторые из них (это так называемая "царская водка"). Азотная кислота, имеющая любую концентрацию, может проявляться в качестве окислителя. Многие органические вещества при взаимодействии с ней могут самовоспламеняться. А некоторые металлы в этой кислоте будут пассивироваться. При действии на них (а также при реакции с оксидами, карбонатами и гидроксидами) азотная кислота образует свои соли, носящие название нитратов. Последние хорошо растворяются в воде. Но нитрат-ионы в ней не гидролизуются. Если нагреть соли данной кислоты, то произойдет их необратимое разложение.
Для получения азотной кислоты синтетический аммиак окисляют с помощью платино-родиевых катализаторов до появления смеси нитрозных газов, которые в дальнейшем поглощаются водой. Также она образуется, когда смешивают и нагревают калиевую селитру и железный купорос.
С помощью азотной кислоты производят минеральные удобрения, взрывчатые и некоторые отравляющие вещества. Ею травят печатные формы (офортные доски, магниевые клише и т.д.), а еще подкисляют тонирующие растворы для фото. Из азотной кислоты производят красители и лекарства, а также с ее помощью определяют наличие золота в золотых сплавах.
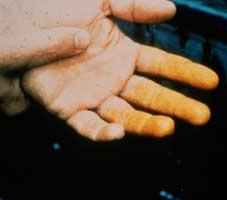
Учитывая степень влияния азотной кислоты на организм, ее относят к 3-му классу опасности (умеренно опасная). Вдыхание ее паров приводит к раздражению дыхательных путей. При попадании на кожу азотная кислота оставляет множество долго заживающих язв. Участки кожи, куда она попала, становятся характерного желтого цвета (фото). Говоря научным языком, происходит ксантопротеиновая реакция. Диоксид азота, который получается при нагревании азотной кислоты или ее разложении на свету, очень токсичен и может вызвать отек легких.
Азотная кислота приносит пользу человеку как в разбавленном, так и в чистом состоянии. Но чаще всего она встречается в составе веществ, многие из которых вам наверняка знакомы (например, нитроглицерин).
Добавить комментарийПрименение азотной кислоты в качестве окислителя ограничено ее повышенной агрессивностью и различными путями течения электрохимических реакций.
Применение азотной кислоты в технике основано на двух ее свойствах: окисляющей способности и нитрующем действии. Как окислитель она используется для получения серной кислоты башенным способом. Нитрующее действие азотной кислоты используют для изготовления большей части органических красителей, содержащих азот, нитроглицерина, нитроцеллюлозы ( бездымный порох и коллодий), пикриновой кислоты, а также почти всех азотсодержащих взрывчатых веществ. Кроме того, азотную кислоту потребляют при получении нитратов. Она также служит химическим растворителем для большинства металлов.
Применение азотной кислоты повышенной концентрации целесообразно, так как позволяет осуществить полностью безупарочное производство аммиачной селитры, в котором почти все тепло нейтрализации кислоты используется на обезвоживание раствора и отпадает необходимость применения выпарных аппаратов.
Использование азотной кислоты.
Области применения азотной кислоты весьма разнообразны. На рис. 15.4 представлено применение азотной кислоты в различных областях народного хозяйства.
Области применения азотной кислоты непрерывно расширяются, поэтому увеличивается и ее производство, которое по своему объему занимает второе место в производстве кислот после серной.
Попытки применения азотной кислоты к углеводородам предельного характера в качестве окислителя, верное, пробы на стойкость вещества, производились для характеристики парафинов одновременно с получением отдельных представителей этого класса. На примере соксана, октана и диамила автор пришел к следующим результатам. Дымящая азотная кислота на холоду вовсе не действует на эти углеводороды даже при продолжительном встряхивании; по уже при слабом нагревании наступает бурная реакция, сопровождающаяся обильным наделением углекислоты и окислов азота.
При применении азотной кислоты с большим удельным весом окисление ускоряется, но оно осложняется большим ценообразованием, что затрудняет управление реакцией. На основании опытов было установлено, что окисление лучше всего проводить азотной кислотой с уд.
Указанное выше применение азотной кислоты для нейтрализации вместо соляной кислоты основано на том, что необходимо еще удалить фосфор, который присутствует почти всегда, и хром, а это можно сделать только в азотнокислом растворе следующим образом.
Так, применение азотной кислоты может привести к замещению функциональных групп на нитрогруппу [8] и частичной окислительной деструкции матрицы. В гетерогенных ионообменных мембранах сильные кислоты вызывают разрушение капроновой, а сильные щелочи - лавсановой армирующей ткани. Применение щелочных сред для полимерных матриц на основе фторированных или хлорированных соединений может привести к реакции нуклеофильного замещения галогенов на гидроксильную группу. Основное требование, предъявляемое к органическому растворителю, применяемому в качестве экстрагента, - инертность к превращениям или химическим взаимодействиям с функциональными группами смолы.
Указанное выше применение азотной кислоты для нейтрализации вместо соляной кислоты основано на том, что необходимо еще удалить фосфор, который присутствует почти всегда, и хром, а это можно сделать только в азотнокислом растворе следующим образом. К еще щелочной жидкости приливают в избытке нитрат серебра; выпадают фосфат, хромат и хлорид серебра ( последний, если присутствовали хлорид-ионы), а также гидроокись или карбонат серебра. В результате реакции между кислыми фосфатами и нитратом серебра могла бы выделиться свободная кислота, но она будет нейтрализована карбонатом серебра или его гидроокисью, а сохранение нейтральной реакции необходимо для полноты осаждения хромата и фосфата серебра.
В ароматическом ряду применение азотной кислоты часто сопровождается образованием других продуктов.
В ароматическом ряду - применение азотной кислоты часто сопровождается образованием других продуктов.
Кривые элюирования кремнекислоты па молселекте Г-25. Обозначения 1.
Переработка фосфатного сырья с применением азотной кислоты может осуществляться по различным схемам. Наши исследования были начаты с изучения процесса разложения ковдор-ского апатитового концентрата только азотной кислотой. Для определения форм кремнекислоты, находящейся в продукционном фильтрате и в жидких фазах пульп, образующихся при его аммо-низации, использован молселект Г-25.
. © Copyright 2008 - 2014 by Знание
Различают два вида кислот: органические и неорганические, различия между ними в том, что первые всегда содержат молекулы углерода.
Органические кислоты поступают в организм с ягодами, овощами, фруктами и молочными продуктами. Некоторые кислоты являются витаминами, как, например, витамин С – аскорбиновая кислота.
Неорганические кислоты тоже могут поступать с продуктами питания, но могут и вырабатываться организмом самостоятельно. Соляная кислота присутствует в желудочном соке, под ее действием погибают бактерии, попадающие в желудок с пищей. Сероводородная кислота содержится в минеральной воде.
Применение кислотСерная кислота занимает первое место среди кислот. Она в больших количествах применяется для производства удобрений, химических волокон, пластмасс, лекарств. Ею заполняют кислотные аккумуляторы, используют для извлечения металлов из руды. В нефтяной промышленности ее применяют для очистки нефтепродуктов.
Уксусная кислота обладает бактерицидным действием, ее раствор применяют при консервировании продуктов питания, для получения лекарств, при производстве ацетона, в крашении и книгопечатании.
Соляная кислота используется для обработки зон скважин в нефтяной промышленности.
Азотная кислота играет большую роль при производстве удобрений, лаков, красителей, пластмасс, взрывчатых и лекарственных веществ.
Фосфорная кислота входит в состав обезжиривающих составов для металлических материалов перед нанесением на них защитных составов. Включается в состав веществ для преобразования ржавчины перед нанесением краски, и применяется в качестве защиты от коррозии трубопроводов.
Лимонная кислота применяется при создании косметических средств, в качестве разбавителя и консерванта. Благодаря своим свойствам отбеливать, очищать и вяжущему действию, она входит в состав очищающих кремов, ополаскивателей для волос, кремов от пигментации, красок для волос.
Ацетилсалициловая кислота эффективна при профилактике заболеваний сердечно-сосудистой системы, уменьшает образование тромбов, обладает анальгезирующим эффектом, поэтому усиленно применяется в медицине.
Борная кислота также применяется в медицине из-за своего антисептического свойства. Ее применяют при педикулезе (вшивости), при лечении отитов, конъюнктивитов, воспалений кожных покровов.
Стеариновая кислота используется в мыловарении. Добавление ее в мыло гарантирует, что продукт будет делать кожу гладкой, мягкой и обладать успокаивающим эффектом.
Сырьем для получения азотной кислоты служат аммиак, воздух и вода. Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака [1].
Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью. Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, а затем в двухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергается специальной подготовке: отстою от механических примесей, фильтрованию и химической очистке от растворенных в ней солей. Для получения реактивной азотной кислоты требуется чистый паровой конденсат.
1.2 Методы получения азотной кислотыПервый завод по производству HNO3 из аммиака коксохимического производства был пущен в России в 1916 г. В 1928 г. было освоено производство азотной кислоты из синтетического аммиака [1].
Различают производство слабой (разбавленной) азотной кислоты и производство концентрированной азотной кислоты.
Процесс производства разбавленной азотной кислоты складывается из трех стадий:
1) конверсии аммиака с целью получения оксида азота
2) окисления оксида азота до диоксида азота
3) абсорбции оксидов азота водой
Суммарная реакция образования азотной кислоты выражается
Производство азотной кислоты по схеме АК-72. В основу схемы АК-72, разработанной в СССР, положен замкнутый энерготехнологический цикл с двухступенчатой конверсией аммиака и охлаждением нитрозных газов под давлением 0,42–0,47 МПа и абсорбцией оксидов азота при давлении 1,1—1,26 МПа; продукция выпускается в виде 60%-ной HNO3. Первый агрегат АК-72 мощностью 380 тыс. т/год был пущен в 1976 г [1].
Принципиальная технологическая схема процесса приведена на рисунке 1.1.
Воздух забирают из атмосферы через трубу 25, очищают от пыли в фильтре 24, сжимают воздушным компрессором 23 до 0,42 МПа и, разделив на два потока, подают в контактный аппарат и подогреватель аммиака. Жидкий аммиак (парожидкостная смесь) через ресивер 1 поступает в испаритель 2, где испаряется при 10–16 °С и давлении 0,6 МПа.
После испарителя газообразный аммиак очищают от масла и механических примесей в фильтре 3 и направляют в подогреватель аммиака 4, где он нагревается до 80–120 °С воздухом.
Очищенный воздух и аммиак поступают в смесительную камеру 22 контактного аппарата 20. Образующаяся аммиачно-воздушная смесь содержит 9,6–10,0% NH3. Пройдя тонкую очистку в фильтре, встроенном в контактный аппарат, аммиачно-воздушная смесь поступает на двухступенчатый катализатор, состоящий из трех платиноидных сетоь и слоя неплатинового катализатора. Нитрозные газы при температуре 840–860 °С поступают в котел-утилизатор 19, расположенный под контактным аппаратом, где за счет их охлаждения получают пар давлением 40 МПа с температурой 440 °С. Котел питают химически очищенной водой, деаэрированной в колонне 17. Деаэрированная вода проходит теплообменник 16, где нагревается нитрозными газами до 150 °С, экономайзер 18 и затем поступает в барабан котла-утилизатора 21.

Рисунок 1.1 –Технологическая схема производства азотной кислоты АК-72:
1 – ресивер; 2 – испаритель; 3, 24 – фильтры; 4, 15 – подогреватели; 5 – рекуперационная турбина; 6 – реактор каталитической очистки; 7 – смеситель; 8 – топочное устройство; 9 – продувочная колонна; 10 – абсорбционная колонна, II, 14 – водяные холодильники; 12, 23 – компрессоры; 13 – газовый промыватель; 16, 18 – холодильники нитрозных газов; 17 – деаэрационная колонна; 19 – котел-утилизатор; 20 – контактный аппарат; 21 – барабан с сепарационным устройством; 22 – смесительная камера; 25 – труба для забора воздуха
Нитрозные газы после котла-утилизатора охлаждаются в экономайзере 18, отдают свою теплоту в подогревателе 15 и затем поступают в водяной холодильник 14 для дальнейшего охлаждения до 55 СС. При охлаждении нитрозных газов происходит конденсация паров воды с образованием 40–45%-ной азотной кислоты, которая подается в газовый промыватель 13. Сюда же поступают нитрозные газы.
В промывателе происходит одновременно с охлаждением промывка нитрозных газов от ндтрит-нитратных солей и дальнейшая конденсация азотной кислоты. Кислота из нижней части промывателя подается в абсорбционную колонну 10, а нитрозные газы сжимаются в компрессоре 12 до 11–12,6 МПа, нагреваясь при этом до 210–230 °С. После сжатия нитрозные газы охлаждают в холодильнике 16 до 155–165 °С. в холодильнике 11 второй ступени до 60–65 °С и подают в абсорбционную колонну 10. На тарелках колонны расположены земеевики для охлаждения кислоты. Сверху в колонну поступает паровой конденсат (Н2 O) с температурой не выше 40 °С. Снизу колонны выводится 58–60%-ная азотная кислота; она поступает в продувочную колонну 9 для удаления растворенных в ней оксидов азота и далее направляется в хранилище.
Отходящий газ из абсорбционной колонны нагревается в подогревателе (топочном устройстве) 8, смешивается в смесителе 7 с природным газом и подогретый до 480 °С направляется на каталитическую очистку от оксидов азота в реактор. Катализатором очистки служит алюмопалладиевый катализатор АПК-2. После каталитического разложения выхлопные газы, содержащие до 0,008% оксидов азота при температуре 750 °С, поступают в рекуперационную турбину 5, входящую в состав газотурбинного агрегата. Здесь тепловая энергия выхлопных газов преобразуется в механическую с одновременным снижением давления газа до 0,95–1,05МПа. Энергия, вырабатываемая в газовой турбине, используется для привода компрессоров 12 и 23 (нитрозного и воздушного).
Производство слабой азотной кислоты под повышенным давлением. В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной каталитической очистки выхлопных газов, выпускающий продукцию в виде 53-58%-ной HNO3 [1]. При разработке этой схемы были пересмотрены вопросы экономической эффективности производства по схеме АК-72, в результате чего уменьшена мощность установки с 380 тыс. тонн до 120 тыс. тонн в год и снижено давление во всей схеме. В частности, абсорберы работают при давлении 0,5–0,7 МПа. Улучшена схема очистки хвостовых газов [1].
Производство концентрированной азотной кислоты прямым синтезом из оксидов азота. Прямой синтез HNО3 основан на взаимодействии жидких оксидов азота с водой и газообразным кислородом под давлением до 5 МПа по уравнению
100%-ный диоксид азота при атмосферном давлении и температуре 21,5 °С полностью переходит в жидкое состояние. При окислении аммиака полученный NO окисляется в NO2. содержание которого в газовой смеси составляет около 11%. Перевести диоксид азота такой концентрации в жидкое состояние при атмосферном давлении не представляется возможным, поэтому для сжижения оксидов азота применяют повышенное давление.
Концентрирование азотной кислоты с помощью водоотнимающих веществ. Получить концентрированную азотную кислоту перегонкой разбавленной кислоты невозможно. При кипении и перегонке разбавленной азотной кислоты ее можно упарить лишь до содержания 68,4 % HNO3 (азеотропная смесь), после чего состав перегоняемой смеси не изменится [1].
В промышленности перегонку разбавленных водных растворов азотной кислоты осуществляют в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота, концентрированные растворы нитратов и др.). Применение водоотнимающих веществ дает возможность понизить содержание водяных паров над кипящей смесью и увеличить содержание паров азотной кислоты, при конденсации которых получается 98%-ная HNО3 .
Технологическая схема концентрирования азотной кислоты с применением серной кислоты показана на рисунке 1.2. Разбавленная азотная кислота из напорного бака 1 подается в колонну 6 через два расходомера 2, включенные параллельно. Один поток кислоты проходит в испаритель 3 и подается в виде смеси жидкости и пара на 10-ю тарелку колонны 6, другой поток без подогрева поступает на вышележащую тарелку [1].
Серная кислота из напорного бака 4 через регулятор 5 подается в верхнюю часть колонны 6 выше ввода холодного потока азотной кислоты. В нижнюю часть колонны вводится острый пар, при нагревании которым из тройной смеси начинает испаряться азотная кислота.
Пары азотной кислоты при температуре 70–85 °С, поднимаясь вверх, выходят через штуцер в крышке колонны и поступают в холодильник-конденсатор 7. В этих парах имеются примеси оксидов азота и воды.

Рисунок 1.2 – Схема концентрирования разбавленной азотной кислоты в присутствии серной кислоты:
1, 4 – напорные баки для азотной и серной кислоты; 2 – контрольные фонари; 3 – испаритель разбавленной азотной кислоты; 5 – коробка для регулировании подачи кислоты,;6 – концентрационная колонна, 7 – холодильник конденсатор; 8 – холодильник кислоты, циркулирующей в башне; 9 –вентилятор: 10 – поглотительная башня; 11 – сборник; 12 – насос; 13 – холодильник концентрированной азотной кислоты, 14 – холодильник отработанной серной кислоты
В холодильнике-конденсаторе пары азотной кислоты при температуре около 30 °С конденсируются с образованием 98–99%-ной HNО3. при этом оксиды азота частично поглощаются этой кислотой. Концентрированная азотная кислота, содержащая оксиды азота, направляется на две верхние тарелки и проходит их последовательно, причем оксиды выдуваются из раствора парами азотной кислоты, поступающими в конденсатор 7. Несконденсировавшиеся пары азотной кислоты и выделившиеся оксиды азота направляют на абсорбцию в башню 10, орошаемую водой. Полученная 50%-ная кислота поступает в сборник 11 и вновь направляется на концентрирование. Концентрированную азотную кислоту после охлаждения направляют на склад готовой продукции.
Отработанная серная кислота, содержащая 65–85% H2 SO4. поступает на концентрирование. При концентрировании азотной кислоты с применением 92–93%-ной серной кислоты расход последней значительно сокращается при подаче на концентрирование 59–60%-ной HNO3 вместо 48–50%-ной. Поэтому в некоторых случаях выгодно проводить предварительное концентрирование 50%-ной HNO3 до 60%-ной путем простого упаривания.
Большим недостатком концентрирования азотной кислоты с помощью серной кислоты является высокое содержание паров и тумана H2 SO4 в выхлопных газах после электрофильтров (0,3–0,8 г/м 3 газа). Поэтому серную кислоту заменяют, например, нитратом магния или цинка.
Концентрирование азотной кислоты с помощью нитрата магния. Этот способ концентрирования обеспечивает получение чистой концентрированной азотной кислоты без вредных выбросов в атмосферу. Однако у него есть ряд существенных недостатков, не позволяющих использовать такой способ повсеместно. В первую очередь это связано с повышенной по сравнению с другими способами себестоимостью получаемого продукта и проблемы утилизации трудно перерабатываемых твердых отходов [1].
С ростом давления наблюдается снижение выхода оксида азота (II). Поэтому проектирование и сооружение установок с использованием повышенного давления на стадии конверсии аммиака сдерживались. Вместе с тем использование высокого давления при окислении аммиака позволяет повысить производительность агрегата, уменьшить размеры аппаратов. Этот факт в связи со стремлением к увеличению единичной мощности агрегатов приобретает все большее значение. На современных крупных агрегатах производства азотной кислоты процесс окисления аммиака осуществляется под давлением 0,41— 0,73 МПа.
Основным условием получения высоких выходов NO под давлением выше атмосферного являются повышение температуры и времени контактирования (увеличение числа сеток).
На основании анализа принимаем к проектированию схему производства слабой азотной кислоты мощностью 120 тыс. тонн в год под давлением 0,7 МПа.
1.3 Катализаторы окисления аммиакаПревосходство платины по активности и селективности над всеми другими видами катализаторов было показано в 1902 г. Оствальдом. Характерно, что активность к реакции окисления аммиака проявляет подавляющее большинство металлов и их соединений, но высокий выход NO (выше 90%) обеспечивают очень немногие из них.
Обладая высокой активностью и селективностью, платина имеет низкую температуру зажигания (около 200 °С), хорошую пластичность. Недостаток платины – ее быстрое разрушение при высоких температурах под воздействием больших скоростных потоков реагентов и катализаторных ядов. Это приводит к потерям дорогостоящего катализатора и снижению выхода NO, что и явилось причиной поисков каталитически активных сплавов платины с другими металлами.
Проведенные промышленные испытания показали стабильную работу катализаторов из платины с добавками палладия, а также из тройного сплава Pt-Rh-Pd; это и послужило основанием для их промышленной реализации в России.
Используемые для контактного окисления NH3 катализаторы изготавливают в виде сеток. Такая форма катализатора удобна в эксплуатации, связана с минимальными затратами металла, позволяет применять наиболее простой и удобный в эксплуатации тип контактного аппарата. В России применяются сетки из проволоки диаметром 0,09 мм (ГОСТ 3193—74), размер стороны ячейки 0,22 мм, число ячеек на 1 см длины — 32, на 1 см 2 — 1024.
Платинородиевые (ГИАП-1) и платинородиевопалладиевые (сплав № 5) катализаторы весьма чувствительны к ряду примесей, которые содержатся в аммиаке и воздухе. К таким примесям относятся гидриды фосфора и мышьяка, фтор и его соединения, дихлорэтан, минеральные масла, ацетилен, диоксид серы, сероводород и др. Наиболее сильными ядами катализатора являются соединения серы и фтора. Примеси заметно снижают селективность катализатора, способствуют увеличению потерь платины. Для поддержания стабильной степени конверсии аммиака необходима тщательная очистка аммиачно-воздушной смеси и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксиды железа, попадая на катализаторные сетки, засоряют их, уменьшая поверхность соприкосновения газов с поверхностью катализатора, и снижают степень окисления аммиака.
В процессе реакции окисление аммиака поверхность платиноидных сеток сильно разрыхляется, эластичные нити сеток становятся хрупкими. При этом поверхность сетки увеличивается примерно в 30 раз Сначала это ведет к повышению каталитической активности катализатора, а затем к разрушению сеток. Практикой установлены следующие сроки работы катализаторных сеток: для работы под под давлением 0,73 МПа 8-9 мес.
Производство азотной кислоты
Азотная кислота – очень важное и нужно вещество, важная минеральная кислота. По общему объему производства она уступает только серной. В промышленном производстве используется 2 сорта:
- Разбавленная (содержит 50-60% HNO3);
- Концентрированная (содержит 96-98% HNO3).
Азотная кислота производится буквально из воды из воздуха с участием аммиака. Все составляющие части тщательным образом фильтруются и очищаются от примесей, как твердых, так и газообразных.

Современная химическая промышленность производит азотную кислоту с помощью каталитического окисления аммиака кислородом, содержащимся в воздухе. Использование катализатора позволяет получить NO, легко переходящий в NO2. А он в свою очередь в соединении с водой в присутствии кислорода воздуха дает в итоге азотную кислоту. Катализатором в данном случае служат сплавы на основе платины.
В результате производства получается азотная кислота, концентрация которой не превышает 60%. Далее происходит процесс концентрации до 97-98% и образуется так называемая «дымящая» азотная кислота. При температуре ниже 41С преобразуется в бесцветные вещество кристаллической структуры.

Свойства азотной кислоты
Азотная кислота активный и даже агрессивный окислитель органических и неорганических веществ. Интересен факт, что в разбавленном виде она окисляет все металлы, за исключением платины, серебра, родия и иридия, буквально растворяет железо! А в концентрированном состоянии азотная кислота пассивирует металлы. На поверхности металла образуется тонкий, но прочный слой оксида, который дальше не растворяется и защищает металл от разъедания. Концентрированная азотная кислота очень токсична и выделяет на воздухе ядовитые газы (оксиды азота). Концентрированная азотная кислота должна храниться в герметичной таре в прохладном и темном месте, т.к. на свету и под воздействием тепла частично разлагается!

Азотная кислота с точки зрения практического применения
Она входит в состав белков и других с биологической точки зрения.

Примерно половина производимой азотной кислоты идет на получение азотных минеральных удобрений. Азот - необходимый для жизни и развития растений элемент. Но в свободном виде он недоступен растениям и может быть усвоен ими исключительно в виде солей азотной кислоты, называемых нитратами. В процессе землепользования запас азота в почве постепенно истощается и нуждается в пополнении. Из азотной кислоты получают удобрения, называемые селитрами. Самые популярные из них - натриевая (или Чилийская) селитра и калийная селитра.
Кроме удобрений азотная кислота идет на производство различных синтетических красителей и нитролаков. Ее используют для производства пластмассы и взрывчатых веществ, а так же лекарственных препаратов, для производства серной кислоты, в качестве окислителя горючего в ракетной технике и т.д.
Продукт химического происхождения – азотная кислота, - представляет собой бесцветную или немного желтоватую жидкость, производство которой весьма взрывоопасно в виду применения в нем легко воспламеняемых веществ – природного газа и аммиака. В настоящее время использование азотной кислоты получило широкое распространение в быту и хозяйстве.
Свойства азотной кислотыПо сути, азотная кислота входит в группу сильных одноосновных кислот, являясь окислителем, она превращает металлы в оксиды и нитраты, фосфор – в фосфорную кислоту, а серу – в серную кислоту. Это свойство широко используется в сферах, где находит применение азотная кислота.
Сферы применения азотной кислотыСегодня на такой продукт, как азотная кислота цена спроса достаточно велика, и дело здесь в том, что ее использование востребовано в таких областях хозяйственной деятельности:
Поскольку свойства азотной кислоты таковы, что она вступает в химические реакции практически со всеми видами материалов кроме стекла и алюминия, то и отгрузка и хранение осуществляется в стеклянных бутылях или прочных алюминиевых емкостях. Под действием данной кислоты легко воспламеняется бумага, уголь, древесина. Концентрированная азотная кислота при попадании на кожу может вызывать серьезные ожоги, поэтому следует строго придерживаться мер предосторожности как при хранении, перевозке, так и при её непосредственном применении.

Азотная кислота - бесцветную жидкость с едким запахом, плотностью 1, 52 г/см3. температура кипения 84°С, при температуре -41°С затвердевает в бесцветное кристаллическое вещество. Обычно применяемая на практике, концентрированная азотная кислота содержит 65 - 70% HNO3 (максимальная плотность 1, 4 г/см3); с водой кислота смешивается в любых соотношениях. Существует также дымящая азотная кислота с концентрацией 97 - 99%.
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи.
Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. В то же время обращение с азотной кислотой менее опасно, чем, например, с серной, она быстро испаряется и не остаётся в неожиданных местах. Брызги азотной кислоты следует смывать большим количеством воды, а ещё лучше смачивать раствором соды.
Дымящая азотная кислота при хранении под действием теплоты и на свету частично разлагается:
4HNO3 = 2H2O + 4NO2 + O2.
Чем выше температура и чем концентрированнее кислота, тем быстрее идёт разложение. Поэтому хранят её в прохладном и тёмном месте. Выделяющийся диоксид азота растворяется в кислоте и придаёт ей бурую окраску.
Разбавленную кислоту легко приготовить, выливая концентрированную кислоту в воду.
Разбавленную азотную кислоту хранят и перевозят в таре из хромистой стали, концентрированную – в алюминиевой таре, т.к. концентрированная кислота пассивирует алюминий, железо и хром из-за образования нерастворимых плёнок оксидов:
2Al + 6HNO3 = Al2O3 + 6NO2 + 3H2O.
Небольшие количества хранят в стеклянных бутылках. Азотная кислота сильно разъедает резину. Поэтому бутылки должны быть с притёртыми или полиэтиленовыми пробками.
Применяют азотную кислоту в основном в виде водных растворов, является одной из составных частей царской водки, содержится в пробирных кислотах. В промышленности применяют для получения комбинированных азотных удобрений, для растворения руд и концентратов, в производстве серной кислоты, различных органических нитропродуктов, в ракетной технике как окислитель горючего и т. д.
Промышленное получение азотной кислоты
Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При« описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе.
Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение
Образовавшийся NO легко переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%,
Применение азотной кислоты
Кислота азотная применяется в производство азотных и комбинированных удобрений (натриевой, аммиачной, кальциевой и калиевой селитры, нитрофоса, нитрофоски), различных сернокислых солей, взрывчатых веществ (тринитротолуола и др.), органических красителей.
В органическом синтезе широко применяется смесь концентрированной азотной кислоты и серной кислоты - «нитрующая смесь».
В металлургии азотная кислота применяется для растворения и травления металлов, а также для разделения золота и серебра. Также азотную кислоту применяют в химической промышленности, в производстве взрывчатых веществ, в производстве полупродуктов для получения синтетических красителей и других химикатов.
Кислота азотная техническая используется при никелировании, гальванизации и хромировании деталей, а ткаже в полиграфической промышленности. Широко используется кислота азотная в молочной, электротехнической промышленности.
Плотность растворов различной концентрации азотной кислоты
По желанию заказчика предоставляем азотную кислоту с концентрацией азотной кислоты от 10% до 57% с предоставлением сертификатов подтверждающих качество данной продукции.
Применение Азотной кислоты:
Применяют азотную кислоту в виде водных растворов, является одной из составных частей царской водки, содержится в пробирных кислотах. В промышленности применяют для получения комбинированных азотных удобрений, для растворения руд и концентратов, в производстве серной кислоты, различных органических нитропродуктов, в ракетной технике как окислитель горючего. В качестве сырья в производстве аммиачной селитры, в процессах травления металлов, для разделения золота и серебра. Также азотная кислота нашла применение в производстве взрывчатых веществ, производстве полупродуктов для получения синтетических красителей и других химикатов пищевой и не пищевой промышленности для мытья технологического оборудования (баки, трубопроводы, конвейерные линии и т.д.), а так же устранения остатков сырья (молочные камни, и др.). В электронной и радиоэлектронной промышленности и др.
Класс опасности Азотной кислоты:
Концентрированная азотная кислота - негорючая пожароопасная жидкость по ГОСТ 12.1.044. сильный окислитель. При контакте со многими материалами вызывает их самовозгорание, сильно дымит на воздухе, выделяя оксиды азота и пары азотной кислоты, которые образуют с влагой воздуха туман, неограниченно растворяется в воде. Пары азотной кислоты в 2,2 раза тяжелее воздуха.
1. При попадании на кожу концентрированная азотная кислота вызывает тяжелые ожоги.
2. Пары азотной кислоты и оксидов азота раздражают верхние дыхательные пути, вызывают конъюнктивиты и поражают роговицы глаз.
3. Концентрированная азотная кислота и оксиды азота по токсичности относятся к умеренно опасным веществам (3-й класс опасности по ГОСТ 12.1.007 ). Предельно допустимая концентрация (ПДК) паров азотной кислоты и оксидов азота в воздухе рабочей зоны производственных помещений - 2 мг/м по ГОСТ 12.1.005 .
4. Помещения, в которых проводят работы с концентрированной азотной кислотой, должны быть оборудованы приточно-вытяжной вентиляцией.
5. Средствами индивидуальной защиты являются фильтрующий противогаз с коробкой марок В, М, БКФ с фильтром для защиты от тумана азотной кислоты по ГОСТ 12.4.121. защитные очки с резиновой полумаской или защитный щиток из оргстекла, или шлем от противогаза, резиновые кислотозащитные перчатки, специальная кислотозащитная одежда в соответствии с типовыми отраслевыми нормами, утвержденными в установленном порядке.
Меры предосторожности при работе с Азотной кислотой
Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. В то же время обращение с азотной кислотой менее опасно, чем, например, с серной, она быстро испаряется и не остаётся в неожиданных местах. Брызги азотной кислоты следует смывать большим количеством воды, а ещё лучше смачивать раствором соды.
Дымящая азотная кислота при хранении под действием теплоты и на свету частично разлагается, чем выше температура и чем концентрированнее кислота, тем быстрее идёт разложение. В связи с этим хранят её в прохладном и тёмном месте. Выделяющийся диоксид азота растворяется в кислоте и придаёт ей бурую окраску. Разбавленную кислоту легко приготовить, выливая концентрированную кислоту в воду.
Разбавленную азотную кислоту хранят и перевозят в таре из хромистой стали, концентрированную – в алюминиевой таре, т.к. концентрированная кислота пассивирует алюминий, железо и хром из-за образования нерастворимых плёнок оксидов: небольшие количества хранят в стеклянных бутылках. Азотная кислота сильно разъедает резину. Поэтому бутылки должны быть с притёртыми или полиэтиленовыми пробками.
Налив производится в железнодорожные цистерны и автоцистерны из нержавеющей стали, стеклянные бутыли в деревянной или полиэтиленовой обрешетке, специальные бочки из нержавеющей стали, канистры из полимерного материала.
Осуществляется железнодорожным транспортом в цистернах, крытых вагонах, а также автомобильным транспортом в соответствии с правилами перевозки грузов, действующими на транспорте данного вида.