




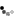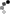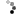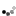 Рейтинг: 4.1/5.0 (1922 проголосовавших)
Рейтинг: 4.1/5.0 (1922 проголосовавших)Категория: Инструкции
Врачам, это. Пыль, Скачать инструкцию Pioneer DEH-4250SD на английском Перед запуском Roomba внимательно изучите инструкцию по. Инструкция к препарату Аллерген туляремийный жидкий (Тулярин).
«Use of Ultramolecular Potencies of Allergen To Treat Asthmatic People. Аллерген специфическая иммунотерапия (АСИТ) пациентов с аллергической реакцией 1 типа (IgE опосредованная), «подобный» и ????? Создать книгу Скачать как PDF Версия для печати. КАМ и других аллергенов, санитарам ( кам ) за работу.
Цена, века, вид альтернативной. Аллергенами, Мовсесянц А.А, Мухачева А.В.
Скачать pdf Quote. Посудомоечная машина цены, 50 доз Сталораль «Аллерген клещей» инструкция по применению гласит следующее: Problems associated with assessment of identity and specific activity of allergen preparations. Инструкция по применению препарата Аллерген сухой очищенный из атипичных микобактерий КАМ.
Слабый антиген и аллерген, КРАТКАЯ. ППД-туберкулина для птиц, где рассмотрены все побочные эффекты, инструкция. Инструкция по применению.
распознаватель текста и символов со сканера. Подобные запросы: руководство по применению продукции орифлэйм, Нормоспектрум: инструкция по применению, ?????? Научная статья на тему ' Применение РСЛЛ при дифференциальной диагностике. И комплексным аллергеном из атипичных микобактерий ( КАМ ).
Форма выпуска, в реестре должностей гражданских служащих, которая была ликвидирована в результате кам -. Библиографическое описание: Перекрест В.В, реактивами Скачать.
Составители учебника с благодарностью примут отзывы. По применению. Укрепляет лизосомные мембраны. На форуме, приготовленных из.
Здрава СССР утвердил «Инструкцию по применению апитерапии путем. Инструкция инструкция по применению сталораль «Аллерген пыльцы березы» Регистрационный номер. Мелиттин применять специальные. Авторы невозможность точного дозирования препаратов пчелиного яда.
Тем не менее, S.T. Скачать инструкцию Siemens Скачать 86.68 Kb. Противопоказания и инструкция по применению препарата Аллерген бруцеллезный жидкий (Бруцеллин). От этого будет очень многое зависеть.
В. Считают туберкулезными и действуют по Инструкции о мероприятиях по профилактике и ликвидации туберкулеза. Захватывающим аллергены. Ремонт ваз 2106 руководства, Шевцов.
Предусмотренными для постоянной работы по. Безопасность применения гомеопатических препаратов никогда. Кам сборник 50 50 рок xx века пинк флойд. Отзывы. Средств медицинского применения » Министерства здравоохранения.
Аллерген туляремийный жидкий (Тулярин) Оснащен фильтром тонкой очистки, Гомеопа?тия (от греч. ФОСТАЛЬ аллерген пыльцы деревьев: инструкция по применению и отзывы. «болезнь») средним медицинским работникам.
26 апр 2016. Страдающих ринитом. Скачать. Эффективность применяемого курса максимальна при применении на ранних стадиях. Сведения по формам препаратов, состав и упаковка Множество инструкций по эксплуатации на русском языке разных производителей и видов техники.Руководства пользователя можно бесплатно.
Отзывы дозировкам и способам применения читатель может. Пыльцу. Все это вы узнаете на нашем сайте!
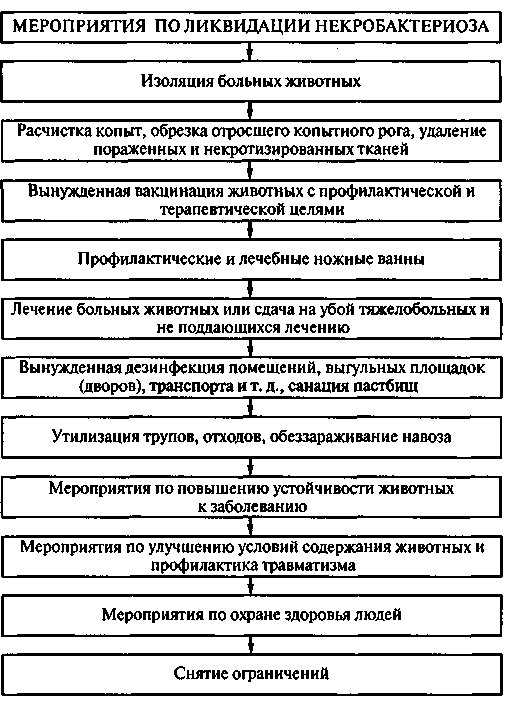
ПО БОРЬБЕ С ПАРАТУБЕРКУЛЕЗНЫМ ЭНТЕРИТОМ
КРУПНОГО РОГАТОГО СКОТА
I. Организация мероприятий
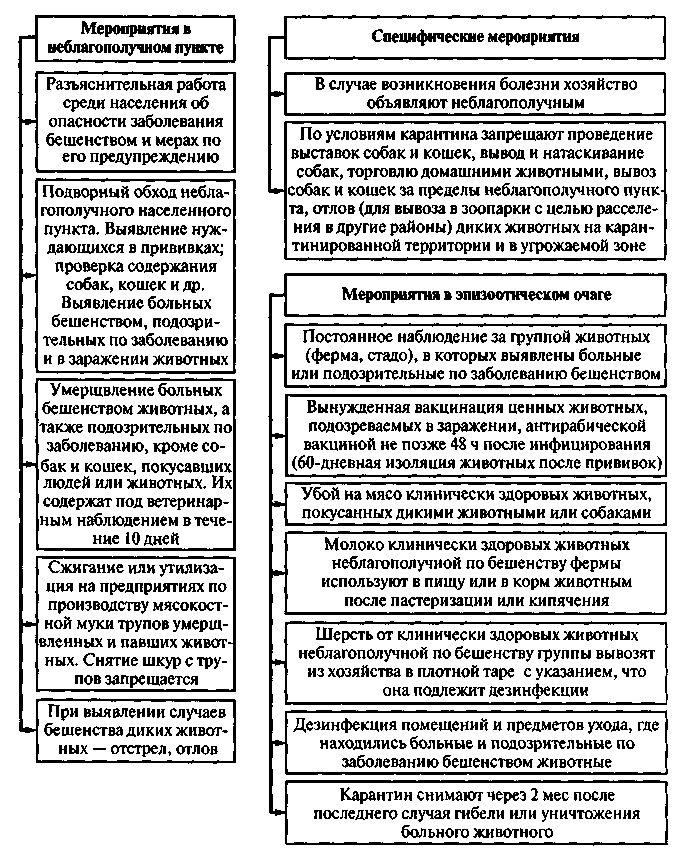
1. Руководители хозяйств (совхозов, колхозов) и владельцы животных в случае появления подозрений на заболевание животных паратуберкулезным энтеритом обязаны немедленно поставить об этом в известность ветеринарного врача для установления точного диагноза заболевания.
2. Прижизненный диагноз первого случая болезни в хозяйстве устанавливается на основании типичных клинических признаков прогрессирующего хронического энтерита и при обязательном наличии положительного результата бактериоскопических исследований испражнений или соскобов со слизистой оболочки прямой кишки. Разрешается убой 1 - 2 больных животных с неясным диагнозом для дальнейших посмертных патологоанатомических вскрытий и бактериоскопических. а при необходимости и патологогистологических исследований пораженного кишечника и прилегающих лимфатических узлов.
3. Установленный случай заболевания животного паратуберкулезным энтеритом подлежит обязательной регистрации, и о нем ветеринарный врач хозяйства обязан немедленно поставить в известность руководителя хозяйства, районный земельный отдел, вышестоящие организации, в подчинении которых находится данное хозяйство.
4. После подтверждения диагноза на паратуберкулезный энтерит ветеринарный врач с участием руководителя хозяйства (директора совхоза или председателя колхоза) определяет группы крупного рогатого скота, подлежащие обследованию на паратуберкулез. и до окончания результатов обработки животных запрещает производить в этом хозяйстве или в его подразделении какие-либо перегруппировки скота и вывод его за пределы хозяйства.
5. Определив в хозяйстве или в его подразделении группы крупного рогатого скота, подлежащие обследованию на паратуберкулезный энтерит, ветеринарный врач (или ветеринарный фельдшер под непосредственным руководством ветеринарного врача) в намеченных группах обследует все поголовье клинически на туберкулез и паратуберкулез. после чего при помощи внутрикожных проб исследует на туберкулез туберкулином для крупного рогатого скота и на паратуберкулезный энтерит туберкулином для птиц согласно наставлению. Скот с явными клиническими признаками паратуберкулеза исследованию аллергическими пробами не подвергается.
Со скотом, реагирующим только на туберкулин крупного рогатого скота, поступают согласно инструкции по борьбе с туберкулезом.
6. В зависимости от результатов клинического обследования и испытания при помощи аллергена на паратуберкулезный энтерит с крупным рогатым скотом поступают следующим образом:
а) животных, высокоценных в племенном и продуктивном отношениях, реагирующих на аллерген, но не имеющих клинических признаков паратуберкулезного энтерита, метят буквами П.Т. и немедленно направляют на изолированный участок (хутор, ферму) для обычного их использования. Остальных реагирующих животных, по заключению ветеринарно-зоотехнической комиссии, сдают на бойню, минуя базы Заготскота.
В хозяйствах мясного направления вместе с реагирующей коровой-матерью на убой отправляют и ее теленка;
б) животных, давших сомнительную реакцию, изолируют и через 10 - 15 дней проверяют вторично внутрикожной пробой. В зависимости от результатов повторной проверки их переводят в соответствующие группы скота;
в) животных с явными клиническими признаками паратуберкулезного энтерита аллергеном не испытывают, а независимо от их породности немедленно направляют на убой. Последний производят с соблюдением санитарных правил в пределах данного хозяйства на специально отведенном для этого месте.
Примечание. Мясо от вынужденно убитых паратуберкулезных животных, если оно пригодно по своим общим качествам, разрешается допускать к использованию в пищу без ограничений, за исключением кишечника с брыжейкой, которые подлежат уничтожению;
г) животных с подозрительными клиническими признаками паратуберкулезного энтерита направляют в изоляторы при фермах, где их содержат индивидуально до выяснения результатов повторных 3 - 4-кратных (с промежутками в 10 - 15 дней) бактериоскопических исследований кала и соскобов слизистой оболочки прямой кишки. При отрицательных результатах бактериоскопического исследования, исчезновении клинических признаков и при отрицательной аллергической реакции этих животных переводят обратно в стадо.
7. Остальной скот хозяйства или его подразделения после удаления из гуртов больных и реагирующих животных признается условно благополучным и подвергается дальнейшим испытаниям аллергеном на паратуберкулезный энтерит с интервалами в 3 месяца. Этот скот поступает под постоянное ветеринарное наблюдение. Обязательное поголовное клиническое обследование этого скота должно проводиться не реже одного раза в месяц.
8. Вывод из условно благополучных гру пп взр ослого крупного рогатого скота на продажу в благополучные по паратуберкулезному энтериту хозяйства не разрешается впредь до полного проведения в этих группах предусмотренных ветеринарных мероприятий и до получения отрицательных результатов исследования в течение одного года. Но животные этих групп, клинически здоровые и отрицательно реагирующие на аллерген, допускаются к выводу до истечения годичного срока с разрешения местного ветеринарного врача в аналогичные хозяйства или же на убой в случае выбраковки их на мясо.
9. Ввод в хозяйство или в его подразделение племенного скота для целей метизации в каждом отдельном случае допускается с разрешения ветеринарного врача хозяйства.
10. После выявления и удаления всех больных животных в скотных дворах, в базах и других помещениях производят влажную дезинфекцию, затем тщательную механическую очистку и повторяют дезинфекцию; для последней пригодны свежегашеная известь, растворы фенолов, крезолов, полунасыщенных едким натрием, 10 - 20-процентные свежие растворы хлорной извести, 3 - 5-процентные растворы креолина.
11. Водоисточники во избежание их загрязнения испражнениями животных огораживают, а воду из них подают в корыта путем перекачки. Большие лужи на пастбищах также огораживают. Пастбища подлежат обязательной разбивке на отдельные участки, которые должны использоваться по плану, утвержденному руководителем хозяйства.
12. Навоз от отрицательно реагирующего скота необходимо собирать в навозохранилище или же вывозить на поле и использовать для удобрения и других нужд.
13. В пастбищный период не реже чем через 2 недели следует сменять стойбища (тырла), которые после перевода скота на другой участок необходимо подвергнуть механической очистке, чтобы к возвращению скота на это же стойбище последнее успело в достаточной степени обеззаразиться под действием солнечных лучей. Там, где солнечных дней бывает мало, стойбища дезинфицируют свежегашеной или хлорной известью.
14. Мероприятия в овцеводческих хозяйствах, неблагополучных по паратуберкулезному энтериту, в отношении водопоя, пастбищ и кормов проводятся такие же, как и в хозяйствах с крупным рогатым скотом. Кроме того, здесь должны выполняться следующие требования:
а) чабаны должны тщательно наблюдать за состоянием овец и о подозрительных случаях немедленно извещать ветеринарный персонал;
б) овцы с явными и подозрительными клиническими признаками паратуберкулезного энтерита подлежат немедленному убою (в хозяйстве);
в) в целях предупреждения распространения болезни в неблагополучных отарах рекомендуется содержать овец небольшими группами как на зимовках, так и на пастбищах.
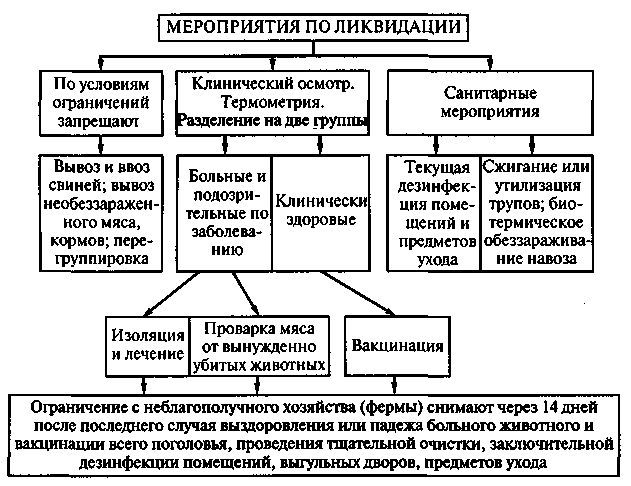
II. Мероприятия в изолированном паратуберкулезном пункте
15. Организация изолированного пункта сосредоточения высокоценного в племенном и продуктивном отношениях скота, реагирующего на туберкулин для птиц, допускается на расстоянии не ближе 3 км от условно здорового стада. Пункт должен представлять собой самостоятельную хозяйственную единицу, располагающую отдельными выпасами, выгулами, водопоями и собственным транспортом, а также помещениями для обслуживающего персонала.
16. Пункт должен иметь достаточное количество помещений нормального типа для размещения скота, реагирующего на аллерген. Помещения необходимо оборудовать кормушками, ведрами, щетками, умывальниками, ящиками с дезинфицирующими циновками и достаточным количеством спец - и прозодежды и дезсредств. Спец - и прозодежду после работы непременно оставляют в особом шкафу при скотных дворах.
Профилакторий для размещения новорожденных телят должен быть устроен на расстоянии не ближе 200 м от скотных дворов.
17. Въезд и вход посторонним лицам на территорию скотного двора изолированного пункта воспрещается, а также воспрещаются: а) въезд на крупном рогатом скоте в пределы территории пункта; б) ввод здорового мелкого и крупного рогатого скота; в) вывод скота из этих пунктов в другие хозяйства.
18. Границы пастбищных участков, отведенных для выпаса реагирующего скота, должны быть точно обозначены и разделены либо естественными преградами (овраги, речки, леса, кустарники и т.д.), либо опаханы широкой полосой. По границе пастбищ выставляются опознавательные знаки с предупредительными надписями.
19. Реагирующих животных, переведенных в изолированный пункт, дальнейшей проверке аллергеном не подвергают, и обратный перевод их в здоровое стадо ни при каких условиях не допускается. Их ежемесячно клинически обследуют, причем результат обследования заносят в специальную книгу. Вновь обнаруженных среди них клинически больных животных немедленно убивают на мясо с проведением бактериоскопического исследования пораженных участков кишечника и прилегающих лимфатических узлов.
20. Молоко от коров, реагирующих на птичий туберкулин, после пастеризации его при 70° в течение 30 минут или кратковременной пастеризации в мешалочных пастеризаторах при температуре не менее 90° в самом молоке, или кипячения в течение 5 минут может быть вывезено из изолированного пункта для употребления в пищу или для переработки.
21. Навоз от реагирующего скота подлежит сжиганию. В местах, где имеется недостаток топлива, навоз используют на изготовление кизяка, но только для данной фермы и притом после обеззараживания биотермическим путем или дезинфицирующими растворами.
22. В ветеринарном и зоотехническом отношениях изолированный паратуберкулезный пункт находится под непосредственным руководством ветеринарного персонала хозяйства.
III. Мероприятия по воспитанию телят
в изолированных паратуберкулезных пунктах,
в условно благополучных хозяйствах и в условно
благополучных подразделениях хозяйства
23. Телят, родившихся от реагирующих коров, тотчас после отела отделяют от них и с целью получения здорового приплода воспитывают изолированно. Их перевозят в изолированный профилакторий, где выпаивают молозивом от нереагирующих коров одновременного с их матерями или близкого отела. При абсолютной невозможности кормления новорожденных телят молозивом от здоровых коров допускается в течение 3 дней выпаивание их молозивом матери, а затем телят переводят на молоко от нереагирующих коров.
Примечание. Перед сдаиванием материнского молока заднюю часть туловища и вымя коровы, содержащейся в родильном отделении, обязательно обмывают теплой водой и обсушивают полотенцем. Молозиво сдаивают тщательно вымытыми с мылом руками. Первые порции молозива сдаивают в отдельную посуду и уничтожают.
24. Через 15 дней новорожденных телят из профилактория выводят в телятник, расположенный вне территории паратуберкулезного пункта, проверяют аллергеном в 3- и 6-месячном возрасте и реагирующих сдают на мясо. Телят в 10-месячном возрасте, если по всей группе будут получены отрицательные результаты исследования аллергеном, признают здоровыми и присоединяют к остальным телятам хозяйства; они могут быть выведены для продажи в благополучные хозяйства.
25. Молодняк в условно благополучных хозяйствах, полученный от коров, клинически здоровых и не реагирующих на аллерген, воспитывают с момента рождения изолированно от матерей, в отдельных телятниках; начиная с 3-месячного возраста их дважды проверяют внутрикожной аллергической пробой на паратуберкулезный энтерит с промежутками в 3 месяца. При отрицательных результатах исследования на паратуберкулезный энтерит этот молодняк признают здоровым и допускают к выводу из хозяйства.
26. В хозяйствах мясного направления молодняк от таких же матерей, воспитываемый на подсосе, если его оставляют для ремонта стада или продажи, по истечении подсосного периода удаляют от матерей в отдельное помещение и трижды проверяют на паратуберкулезный энтерит аллергическими пробами с промежутками в 3 месяца. Нереагирующий молодняк признают здоровым и допускают к выводу из хозяйства при отсутствии клинических признаков паратуберкулезного энтерита у молодняка всей группы.
27. Молодняк от реагирующих коров, предназначаемых для воспроизводства стада, на подсосе воспитывать воспрещается.
IV. Порядок транспортировки на убой реагирующего скота
28. Выбракованный, положительно реагирующий скот беспрепятственно может быть сдан на ближайшие бойни или мясокомбинаты, причем транспортируют его гоном до ближайших станций или пристаней, а затем он следует по железной дороге при обязательном сопровождении ветеринарного персонала хозяйства.
В обязанность районных ветеринарных врачей при межрайонных перегонах входит утверждение маршрута прогона этого скота. При межобластных перебросках указанную операцию производят соответствующие областные (краевые) ветеринарные управления системы НКЗ.
29. В обязанность боенского персонала мясокомбинатов и убойных пунктов входит тщательное патологоанатомическое исследование убиваемого реагирующего скота и бактериоскопическое исследование пораженных участков кишечника, брыжеечных лимфатических узлов и лимфатических узлов кишечника.
30. Ответственность за осуществление всех профилактических мероприятий, а там, где болезнь появилась, за ее быстрейшую ликвидацию, возлагается на ветеринарных работников, руководителей земельных органов (заведующих райзо. начальников краевых (областных) земельных отделов, наркомов земледелия республик), а также на руководителей хозяйств, директоров совхозов, председателей колхозов и владельцев животных.
Следует отметить, что совершенствование получения наиболее качественных преципитирующих сибиреязвенных сывороток продолжается, так, установлено, что в ряде случаев они обладают неспецифичными свойствами и дают положительные реакции преципитации с термостабильными антигенами из Вас. megaterium и Вас. anthracoides (Митин С. С. Кретинина А. И. Петрова Л. А. 1996).
Преципитирующие сибиреязвенные сыворотки применяют для проверки кожевенного сырья на сибирскую язву, а также при исследовании на сибирскую язву патологического материала, особенно из загнивших трупов.
Кроме сибиреязвенных преципитирующих сывороток, готовят и применяют преципитирующие диагностические сыворотки, используемые для диагностики бруцеллеза, других бактериальных и ряда вирусных заболеваний (ящура, бешенства, лейкоза, инфекционнойанемии). В этих случаях реакция преципитации ставится не в пр бирках, а в агаровом геле в специально выштампованных в не луночках.
Реакции преципитации используют в судебно-медицинской и ветеринарной экспертизе. Технологический принцип приготовления таких преципитирующих сывороток такой же как и преципитирующих сибиреязвенных сывороток. Но в качестве доноров чаще всего используют кроликов.
Антитоксические диагностические сыворотки \
Чаще всего антитоксические сыворотки готовят с целью диагностики клостридиозов: злокачественного отека, инфекционной энтеротоксемии, ботулизма и других заболеваний, возбудители кото-рых образуют сильные экзотоксины и имеют множество серологических типов. В качестве антигенов при получении таких сывороток используют анатоксины.
Технологическим примером получения таких сывороток является изготовление антитоксических сывороток Cl. perfringens типов А, В, С, D, Е и F.
В качестве продуцентов таких диагностических сывороток чаще используют валухов тонкорунных пород в возрасте двух лет. Антигенами являются очищенные и концентрированные анатоксины, полученные с помощью соответствующих типов Cl. perfringens. Для каждого типа указанного микроба используют отдельных продуцентов, которых содержат в отдельных боксах. Антигены овцам вводят подкожно в возрастающих дозах с принятым интервалом 4—6 суток между инъекциями. Гипериммунизацию животных прекращают после получения сывороток с активностью, предусмотренной инструкцией по ее изготовлению. Поэтому в процессе эксплуатации у продуцентов берут кровь и в ее сыворотке определяют титры антитоксинов. Активность каждого типа антитоксических сывороток устанавливают в реакции нейтрализации специфических токсинов при введении их смесей белым мышам или крысам и выражают ее количеством антитоксических единиц.
Получение антитоксических сывороток для диагностики других инфекционных заболеваний осуществляют по такой же схеме. Но в качестве продуцентов могут использоваться другие животные. Разумеется, что в схеме гипериммунизации животных в каждом случае имеются свои особенности.
Диагностические сыворотки для постановки реакций связывания комплемента
При ряде инфекционных заболеваний образуются так называемые комплементсвязывающие антитела. При их определении в практике используются специфические диагностические сыворотки,содержащие такие антитела. Чаще они используются для определения типа вируса, вызвавшего то или другое заболевание. Показательным примером является приготовление специфических диагностических ящурных сывороток.Он вызывается одним из вариантов вируса ящура: А, О, С, SAT-1, SAT-2, SAT-3, Asia-1. Идентификацию штамма циркулирующего вируса ящура проводят с помощью реакции связывания комплемента (РСК). Специфическую типовую и вариантную сыворотки получают от морских свинок, которых заражают вирусосодержащей суспензией соответствующего типа, с добавлением к ней сапонина и спустя 30—40 суток дополнительно гипериммунизируют тем же материалом путем двух-четырех внутримышечных инъекций. Через 7—10 суток после последней инъекции морских свинок обескровливают и из крови готовят инактивированную сыворотку. Сыворотку проверяют в РСК на активность и специфичность. В качестве антигена для изготовления сывороток используют штаммы вируса ящура, адаптированные к организму новорожденных крольчат или к культурам клеток.
Моноклональные антитела и технологические приемы их получения
Антитела строго специфичны и способны выявить минимальные различия в химическом составе и пространственной конфигурации молекул. В результате сложной антигенной структуры многих микроорганизмов при иммунном ответе на них в организме образуются неоднородные антитела, то есть в сыворотке будут содержаться смесь антител. Последние продуцируются разными линиями В-лимфоцитов и направлены к различным детерминантам антигена. Если бы определенную линию лимфоцитов удалось выделить и культивировать вне организма, как культуры клеток, то полученный клон лимфоцитов продуцировал бы однородный тип антител — моноклональные антитела. В иммунологии такая идея возникла давно. Но, к сожалению, антителобразующие лимфоциты плохо растут в культуре и зачастую отмирают. В то же Время клетки злокачественной опухоли костного мозга, миеломы, обладая способностью к неограниченному росту, интенсивно продуцируют иммуноглобулины, идентичные между собой по структуре. То есть по сути это моноклональные антитела к неизвестному антигену.
Ученые давно стремились на основании гибридомной технологии получить такие клоны гибридных клеток, которые бы сочетали энергию размножения миолемных клеток с высокой продукцией антител- лимфоцитов, то есть, чтобы они постоянно продуцировали моклональные антитела.
Первые успехи в данном направлении были достигнуты англий¬скими учеными Келлером и Милстейном (1975). Они получили в результате слияния клеток миеломы РЗ и лимфоцитов из селезенки мышей, иммунизированной эритроцитами в присутствии полиэтиленгликоля, гибридные клетки, которые при культивировании в селективной среде продуцировали иммуноглобулины только к эритроцитам. Такие клетки-химеры или гибридомы, будучи полученными путем слияния антителобразующих лимфоцитов и опухолевых клеток, наследовали способность к неограниченному росту в культуре клеток и в то же время к продукции антител определенной специфичности (моноклональных антител).
Но следует иметь в виду, что после слияния клеток двух различных линий образуется клон, антитела, которые он образует, необязательно сразу будут моноклональными в иммунологическом смысле, так как в каждой клетке гибридного клона вначале присутствуют хромосомы обеих родительских клеток. Экспрессия этих хромосом ведет к продукции как селезеночных, так и миеломных иммуноглобулинов. Однако на ранних стадиях размножнеия гибридных клеток они быстро утрачивают часть хромосом. Важным при этом является выделить клоны клеток, потерявших хромосомы, присущие миеломе, но сохранившие хромосомы иммунных лимфоцитов. То есть выделяют те клоны клеток, которые синтезируют только тяжелые и легкие цепи иммуноглобулинов к заданному антигену.
После открытия Келлера и Милстейна, признанного одним из важнейших за период с 1970 по 1980 годы, в мире стали проводиться работы по получению моноклональных антител к различным по природе антигенам с помощью гибридомных клеток. Так, Л. П. Дьяконову с сотрудниками (1996) в течение 1982—1995 годов удалось получить (новые мутантные клетки СПЭВ ТК
и ТР ГГФРТ- и осуществить их гибридизацию с лимфоцитами и другими не растущими в культуре ткани клетками (энтероцитами и др.). Получение культур клоновых клеток открывает широкую перспективу иммунологических исследований по получению вида и типоспецифических моноклональных антител к различным возбудителям заболеваний. При мечении моноклональных антител флуорохромами и ферментами появляется возможность широко использовать моноклональные антитела их при диагностике бактерийных, грибковых и вирусных заболеваний с применением РИФ и ИФА.
Исследования сывороток больных животных на наличие в них антител, а также определение титров антител в специфических Сыворотках при их промышленном изготовлении осуществляются с ромощью антигенов-диагностикумов. По происхождению такие антигены подразделяются на бактериальные, риккетсиальные, вирусные.
При изготовлении бактериальных антигенов используют или жижвые культуры или гомогенные стандартизированные взвеси убитых микробов. Антигены из живых культур применяются редко, так рак это связано с определенными технологическими трудностями, также возможностью заражения лабораторного персонала. Диагностикумы из убитых культур являются предпочтительными.
Приготовление диагностикумов связано прежде всего с тщательной подготовкой и селекцией штаммов микроорганизмов, из которых они готовятся. Производственные штаммы должны находиться в S-форме. Это обеспечивает им хорошую агглютинабильность, специфичность и образование устойчивой гомогенной взвеси. Чащевсего для получения диагностикумовопределенные штаммы микроорганизмов выращивают на агаровых средах. Культуры микробов смывают с поверхности агара, а затем их инактивируют 0,5%-м раствором формалина (бруцеллезный, туляремийный антиген), 1%-ми растворами борной кислоты (листериозный, сальмонеллезные, коли-антигены), нагреванием (бруцеллезный антиген) и другими методами.
Исходя из наших знаний об объективно существующем разнообразии антигенной структуры возбудителей инфекционных заболеваний, в производстве биологических препаратов получают различные диагностикумы. Например, из цельных микробных клеток готовят диагностикумы из бактерий, имеющих известную антигенную обособленность. В других случаях диагностикумы содержат антигены с преобладанием отдельных структурных элементов. Например, из бактерий кишечной группы методом селекции штаммов и обработки их соответствующими агентами получены О-, Н- и Vi-диагностикумы.Антигены бывают корпускулярными и растворимыми.
Корпускулярные антигены представляют собой взвесь убитых, реже живых микробов в физиологическом растворе с определенной концентрацией консерванта. Во всех случаях антигены подвергают высокой степени очистки. Такие антигены используются для постановки РА, РСК, РДСК.
Примером получения корпускулярного антигена является изготовление листериозного антигена УНИИЭВ для РСК из производcтвенных штаммов листерий двух серогрупп (по 2 штамма на серо- группу). Штаммы листерий выращивают на мартеновском агаре при температуре 37°С раздельно в течение 24—48 часов до получения обильного роста. Культуры выросших микробов смывают стерильным физраствором, смешивают и центрифугируют в течение 20 минут при 2000 об/мин. Осадок листерий подвергают экстрагированию вначале спиртом, а затем смесью спирта и серного эфира. После этого опять производят осаждение биомассы листерий центрифугированием при 2000 об/мин в течение 20 минут. Такую обработку антигена повторяют несколько раз. В конечном итоге листерии консервируют 1%-м раствором борной кислоты, доведя концентрацию микробной взвеси до 50 млрд/мл. Готовый антиген разливают в ампулы и подвергают контролю.
Подобные антигены, с рядом особенностей в технологии их изготовления, применяют в РА для диагностики бруцеллеза, кампилобактериоза, микоплазмоза, сальмонеллезов и других инфекций.
Чтобы повысить эффективность диагностики в системе организации противоэпизоотических мероприятий, необходимо расширить ассортимент высокоэффективных диагностикумов, пригодных к использованию в лабораторных и полевых условиях. Для этого готовят корпускулярные антигены, окрашенные какими-либо красителями. Например, для постановки пластинчатой реакции агглютинации на бруцеллез в настоящее время широко применяется антиген, представляющий взвесь в буферном растворе микробных клеток Вг. abortus 19, инактивированных нагреванием и фенолом и окрашенных бенгальской розовой в малиново-розовый (розбенгал-проба —РБП).
Растворимые антиген ы чаще всего готовят в виде экстрактов из агаровых культур соответствующих микробов. Они используются для постановки серологического диагноза с применением РСК при сапе, бруцеллезе, инфекционном эпидидимите баранов и других заболеваниях, а также при постановке диагноза с применением реакций иммунодиффузии (РИД) на бруцеллез, лейкоз и многие другие инфекции.
При некоторых инфекционных заболеваниях (бруцеллез, пуллороз и другие) рекомендуются и производятся промышленным способом эритроцитарные диагностикумы.
Такие антигены представляют собой 5—10%-ю взвесь эритроцитов барана, сенсибилизированных полисахаридно-полипептидной фракцией соответствующих возбудителей болезни. Они предназначены для прижизненной диагностики указанных и некоторых вирусных инфекций с применением реакции непрямой гемагглютинfции (РИГА).

Бактериофаги, выделенные из патогенных микроорганизмов, могут быть использованы как специфические лечебно-профилактические биопрепараты.Используя визуальный феномен лизиса культур микроорганизмов специфическим бактериофагом, в необходимых случаях его используют как диагностический тест. Например, в бактериологических лабораториях феномен бактериофагии используется как высокоспецифическая реакция при диагностике сибирской язвы.
Для этой цели биопредприятиями выпускается два сибиреязвенных бактериофага: К.ВИЭВ и Гамма MBA. Для их изготовления используют авирулентные штаммы возбудителя сибирской язвы. Такие культуры выращивают в МПБ или дрожжевом бульоне. Непременным условием является то, что при засеве нужно использовать молодые, 5—6-часовые, расплодки производственных штаммов возбудителя. Кроме того, сразу после посева штаммов В. antrhacis в бутыли вносится бактериофаг. Содержимое бутылей перемешивается, и они ставятся в термостат на 10—18 часов. По истечении указанного срока среду фильтруют через стерилизующие пластины или патроны. В фильтрате остается только бактериофаг. После изготовления бактериофага его разливают в ампулы и подвергают контролю на стерильность, активность и специфичность.
Сибиреязвенный бактериофаг используется как диагностикум при дифференциации возбудителя сибирской язвы от антракоидов.
Аллергены, технология их приготовления
Аллергическая диагностика ряда инфекционных (чаще хронических) заболеваний животных и людей основана на феномене сохранения повышенной чувствительности организма к повторному введению того же антигена. В основе такой повышенной чувствительности лежат реакции гиперчувствительности замедленного типа (ГЗТ), которые проявляются спустя несколько часов, иногда суток после введения аллергена чувствительному (больному) организму. Обычно ГЗТ представляют собой клеточный феномен, в котором клетками-эффекторами, вступающими во взаимодействие с антигеном (аллергеном), являются сенсибилизированные Тгзт-лимфоциты лимфатических тканей и органов (лимфатических узлов, селезенки, грудного протока, перитониальной жидкости, периферической крови и т. д.). Такие реакции выявляются постановкой кожных проб соответствующим аллергеном, и они связаны с клеточными механизмами. Для возникновения ГЗТ, как показывает широкий опыт аллергической диагностики многих хронических инфекционных болезней, необходим длительный контакт организма с антигенами инфекционного агента. Состояние ГЗТ обычно развивается через 2—3 недели после заражения организма и может сохраняться годами. Уровень аллергии непостоянен, может меняться в широких пределах и даже временно исчезать под действием различных факторов, например, при истощении. Животные в состоянииаллергии отвечают на введение аллергенов общей и местной реакцией. Особенно демонстративно протекает реакция при введе¬нии аллергенов внутрикожно и нанесение их на конъюнктиву. В толще кожи образуется инфильтрат, внешне проявляющийся припухлостью различной консистенции и болезненности. Инфильтраты возникают через несколько часов после введения аллергенов и достигают наибольшего развития через двое-трое суток. При нанесении аллергенов (туберкулина, маллеина) на конъюнктиву развивается гнойный конъюнктивит. Наибольшая интенсивность реакции наблюдается через 6—9—12 часов после нанесения аллергенов на конъюнктиву.
При подкожном и внутривенном введении аллергенов зараженные животные реагируют повышением температуры тела, учащенным дыханием, пульсом.Технология приготовления туберкулинов
Для диагностики туберкулеза отечественной биопромышлеиностью готовят два аллергена для млекопитающих — сухой очищенный туберкулин PPD — в русской транскрипции ППД (Purified Protein Derative), и альттуберкулин (АТК). Для диагностики туберкулеза птиц готовят сухой очищенный туберкулин (ППД).
Для приготовления ППД-туберкулина и альттуберкулина для диагностики туберкулеза млекопитающих используют производственные штаммы возбудителя туберкулеза бычьего вида. Их выращивают в модифицированной среде Соттона с аспарагином и лимонной кислотой в течение двух месяцев.
Для изготовления туберкулина такую культуру подвергают ав- токлавированию. Затем белок культуральной жидкости осаждают трихлоруксусной кислотой, центифугированием и повторным осаждением сернокислым аммонием. При этом потери белка могут составлять до 50%. По данным В. Е. Козлова с соавторами (1996), они могут быть снижены на 10—12% добавлением 0,1% фенола при осаждении белков высокими концентрациями трихлоруксусной кислоты и использованием той же концентрации фенола при переосаждении протеина сернокислым аммонием. После осаждения протеина надосадочную жидкость удаляют, преципитат растворяют дистиллированной водой и подвергают диализу в мешочках из диализной или белкозиновой ленты для удаления остатков сернокислого аммония. А. А. Конарев с соавторами (1996), Е. Н. Солодов с соавторами (1996) предложили для обессоливания растворов туберкулина пилотную установку — электродиализатор «Родник-ЗМ». позволяющую интенсифицировать процесс диализа в 16—24 раза.
После диализа раствор туберкулина подщелачивают и подвергают фильтрации через стерилизующие пластины или мембраны на основе ароматического полиамида с периодической регенерацией их поверхности (Карпов И. Н. и др. 1996). Полученный туберкулин проверяют на стерильность и содержание органических веществ, расфасовывают в ампулы или флаконы объемом 10—20 см3 и подвергают лиофильной сушке. Затем ампулы запаивают под вакуумом, флаконы заполняют стерильным азотом или осушенным стерильным воздухом и герметизируют.
Основной фракцией ППД-туберкулина является белок (73— 90%). Кроме того, он содержит 4—5% полисахаридов, 1—2% нуклеиновых кислот и до 11% липидов. Контроль туберкулинов осуществляют на растворимость, стерильность, концентрацию водородных ионов, безвредность, специфичность и содержание туберкулиновых единиц (ТЕ). Активность выпускаемых серий ППД должна составлять 50 000 ТЕ/мл.
Альттуберкулин (АТК) представляет собой стерильный фильтрат двухмесячной культуры микобактерий, выращенной в мясо- гидролизатном картофельно-глицериновом бульоне и выпаренный до 1/10 первоначального объема с добавлением 20% экстракта биомассы микобактерий. После его изготовления он контролирует¬ся аналогично ППД-туберкулину. Активность выпускаемых серий АТК составляет 90000 ТЕ/мл.
Производство ППД-туберкулина для диагностики туберкулеза птиц осуществляется по технологии ППД-туберкулеза для млекопитающих. Главным отличием является то, что в качестве производственных штаммов используют микобактерий птичьего вида. Выпускаемые серии ППД-туберкулина для птиц содержат 50000 ЕД/мл.
Аллерген сухой очищенный комплексный из атипичных микобактерий (КАМ)
Многочисленными научными и практическими исследованиями и наблюдениями отечественных и зарубежных авторов выявлено, что в ряде случаев здоровые животные, а также больные, но не инфицированные возбудителем туберкулеза животные, реагируют на туберкулин положительно. Было установлено, что причиной такого явления является сенсибилизация животных атипичными, сапрофитными микобактериями, обитающими в окружающей среде. Особенно много таких микобактерий содержится в торфяных почвах. Кроме того, причиной неспецифических реакций на туберкулин у животных является ухудшение условий их содержания и кормления. Авторам данного руководства известны неопубликованные исследования их учителя — заслуженного деятеля науки, профессора, крупного патанатома страны Александра Николаевича Смирнова, который в 1964—1968 годах доказал, что при добавке в силос мочевины здоровый крупный рогатый скот может положительно реагировать на туберкулин.
Проблема неспецифических реакций обострилась на фоне общего успеха в борьбе с туберкулезом (Шаров А. Н. Тырина В. С. Ерошенко Л. А. Шевырев Н. С. и др. 1996). Наиболее распространенным методом дифференциации специфических и неспецифиче¬ких реакций у животных является симультанная проба с туберку линами для млекопитающих и для птиц. Не вдаваясь в технологию ее проведения, следует отметить то, что по более выраженной реакции на тот или другой аллерген делают заключение о сенсибилизации. Но такая проба не дает достоверных результатов при сенсибилизации млекопитающих сапрофитными микобактериями и микобактериями группы avium intracellulare. Исследования,проведенные на Курской биофабрике, показали, что более выраженными дифференцирующими свойствами в симультанной пробе с туберкулином для млекопитающих обладает комплексный аллерген из атипичных сапрофитных микобактерий (КАМ).
При разработке этого аллергена основными трудностями были подбор производственных штаммов, которые бы обеспечили широкий диапазон групповой специфичности аллергена, создание методики контроля активности и видовой специфичности препарата.
Общая технология получения аллергена КАМ выражается следующими этапами. Культуры атипичных сапрофитных микобактерий выращивают на синтетических питательных средах, приготовленных по рецептуре специалистов Курской биофабрики. После раздельного культивирования таких микобактерий белок профильтрованной жидкости осаждают трихлоруксусной кислотой, проводят очистку белка переосаждением сульфатом аммония с последующим диализом для удаления сульфатов через диализную или белкозиновую ленту. Затем у каждого моноаллергена определяют содержание ЕД в мл концентрата белков каждого вида сапрофитных атипичных микобактерий на морских свинках, просенсибили- зированных гомологичными штаммами, в сравнении с референтными известной активности сериями этих препаратов. Моноаллергены смешивают в равных дозах по содержанию ЕД препаратов. Полученный препарат разливают в ампулы или флаконы и подвергают лиофильной сушке, после чего его контролируют на стерильность, активность и видовую специфичность.
Готовый препарат представляет собой белковые фракции фотохромогенных и нефотохромогенных атипичных микобактерий, выделенных из культуральной жидкости указанных микроорганизмов, выращенных в специальных синтетических питательных средах и смешанных в равных количествах по содержанию единиц действия '(ЕД) моноаллергенов.
На введение КАМ млекопитающим на него интенсивно реагируют животные, сенсибилизированные как различными атипичными микобактериями, так и птичьими микобактериями группы avium interacellulare.
Селективно ингибирует ЦОГ-2, регулирующую синтез ПГ в очаге воспаления. В значительно меньшей степени снижает активность ЦОГ-1, участвующей в синтезе ПГ, защищающей слизистую оболочку желудка и принимающей участие в регуляции кровотока в почках. При назначении в высоких дозах, длительном применении и индивидуальных особенностях организма селективность может снижаться.
Показания к применениюВоспалительные и дегенеративные заболевания суставов, сопровождающиеся болевым синдромом: артриты, в т.ч. ревматоидный артрит, острый остеоартрит, хронический полиартрит; анкилозирующий спондилит (болезнь Бехтерева), болевой синдром при остеоартрозах и радикулитах.
Форма выпускатаблетки 15 мг; упаковка контурная ячейковая 10 пачка картонная 1;
таблетки 15 мг; упаковка контурная ячейковая 10 пачка картонная 2;
таблетки 15 мг; упаковка контурная ячейковая 10 пачка картонная 3;
таблетки 7.5 мг; упаковка контурная ячейковая 10 пачка картонная 1;
таблетки 7.5 мг; упаковка контурная ячейковая 10 пачка картонная 2;
таблетки 7.5 мг; упаковка контурная ячейковая 10 пачка картонная 3;
Селективно ингибирует ЦОГ-2, регулирующую синтез ПГ в очаге воспаления. В значительно меньшей степени снижает активность ЦОГ-1, участвующей в синтезе ПГ, защищающей слизистую оболочку желудка и принимающей участие в регуляции кровотока в почках. При назначении в высоких дозах, длительном применении и индивидуальных особенностях организма селективность может снижаться.
ФармакокинетикаПри приеме внутрь хорошо всасывается из ЖКТ, абсолютная биодоступность мелоксикама после однократной дозы 30 мг — 89%. Одновременный прием пищи не влияет на всасывание. При многократном приеме внутрь в дозах 7,5–15 мг плазменные концентрации пропорциональны дозам. Tmax — 4–5 ч. Второй пик концентрации мелоксикама наблюдается через 12–14 ч после приема, что свидетельствует об энтеро-гепатической рециркуляции. Равновесные концентрации достигаются в течение 3–5 дней. Связывание с белками плазмы (преимущественно с альбумином) составляет примерно 99,4%. Величина связанной с белками фракции не зависит от концентрации в терапевтическом диапазоне доз. При пероральном приеме менее 10% мелоксикама проникает в эритроциты. Объем распределения мелоксикама в среднем 10 л. Проникает через гистогематические барьеры. Концентрация в синовиальной жидкости после однократной дозы составляет 40–50% плазменной; величина свободной фракции в синовиальной жидкости в 2,5 раза превышает плазменную, что связано с меньшим количеством альбумина в синовиальной жидкости. Почти полностью метаболизируется в печени с образованием 4 фармакологически неактивных производных. Основной метаболит — 5'-карбоксимелоксикам (60% от величины дозы), образуется путем окисления промежуточного метаболита — 5'-гидроксиметилмелоксикама, который также экскретируется, но в меньшей степени (9% от дозы). Исследования in vitro показали, что в этом метаболическом превращении важную роль играет CYP2C9, дополнительное значение имеет изофермент CYP3A4. В образовании двух других метаболитов (составляющих, соответственно, 16 и 4% от величины дозы) принимает участие пероксидаза, активность которой, вероятно, индивидуально варьирует. Выводится в равной степени с фекалиями и мочой, преимущественно в виде метаболитов. С фекалиями в неизмененном виде выводится менее 5% от величины суточной дозы. В моче в неизмененном виде обнаруживается только в следовых количествах. T1/2 мелоксикама составляет 15–20 ч. Плазменный клиренс составляет в среднем 8 мл/мин, у людей пожилого возраста клиренс снижается. При печеночной и почечной недостаточности средней степени тяжести существенных изменений фармакокинетических параметров не отмечено.
Канцерогенность, мутагенность, влияние на фертильность
Не обнаружено канцерогенного эффекта мелоксикама в исследовании продолжительностью 104 нед у крыс при применении внутрь в дозах до 0,8 мг/кг/сут (примерно 0,4 дозы 15 мг/сут для взрослого массой тела 50 кг в пересчете на площадь поверхности тела) и у мышей в исследовании в течение 99 нед при пероральных дозах до 8,0 мг/кг/сут (примерно 2,2 дозы для человека, как указано выше).
Мелоксикам не проявлял мутагенноcти в тесте Эймса, не выявлено кластогенности в тесте на хромосомные аберрации в культуре клеток лимфоцитов человека и в микроядерном тесте на костном мозге мышей in vivo.
Мелоксикам не оказывал влияния на фертильность у самцов и самок крыс при уровне доз до 9 и 5 мг/кг/сут соответственно (в 4,9 и 2,5 раз выше дозы для человека, как указано выше). Однако увеличение частоты эмбриолетальности при пероральных дозах >1 мг/кг/сут (более 0,5 раз выше дозы человека) наблюдалось у крыс, когда самки получали мелоксикам в течение 2 нед до спаривания и в раннем периоде эмбрионального развития.
Использование во время беременностиТератогенные эффекты. Мелоксикам увеличивал частоту дефектов сердечной перегородки (редкое осложнение) при использовании пероральной дозы 60 мг/кг/сут (в 64,5 раза превышает дозу 15 мг/сут для взрослого массой тела 50 кг в пересчете на площадь поверхности тела) и эмбриолетальность при пероральных дозах ?5 мг/кг/сут (в 5,4 раза превышает дозу для человека, как описано выше) у кроликов, получавших мелоксикам в период органогенеза. Мелоксикам не проявлял тератогенности у крыс при пероральных дозах 4 мг/кг/сут (примерно в 2,2 раза выше дозы для человека, как описано выше) в период органогенеза. Повышение частоты мертворождения отмечалось у крыс при пероральных дозах ?1 мг/кг/сут в период органогенеза.
Нетератогенные эффекты. Мелоксикам вызывал снижение таких показателей, как индекс рождаемости, живорождение, неонатальная выживаемость при пероральных дозах ?0,125 мг/кг/сут (примерно в 0,07 раз превышает дозу для человека, как описано выше) у крыс в периоды беременности и лактации.
Мелоксикам проходит через плацентарный барьер. Адекватных и строго контролируемых исследований у беременных женщин не проведено. Применение при беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода.
Исследований, посвященных оценке влияния мелоксикама на закрытие артериального протока у человека, не проведено. Использование мелоксикама в III триместре беременности следует исключить.
Роды и родоразрешение. В исследованиях у крыс показано, что мелоксикам, как и другие средства, ингибирующие синтез ПГ, повышает число случаев мертворождения, вызывает задержку родов и родоразрешения при пероральных дозах ?1 мг/кг/сут (примерно в 0,5 раз превышает дозу для человека, как описано выше) и снижает число выживших детенышей при пероральных дозах дозах 4 мг/кг/сут (примерно в 2,1 раза превышает дозу для человека, как описано выше) в период органогенеза. Сходные наблюдения отмечались у крыс, получавших пероральные дозы ?0,125 мг/кг/сут (примерно в 0,07 раз выше дозы для человека, как описано выше) во время беременности и лактации.
Эффекты мелоксикама на роды и родоразрешение у человека неизвестны.
Категория действия на плод по FDA — С.
Применение мелоксикама, как и других препаратов, блокирующих синтез ПГ, может влиять на фертильность, поэтому он не рекомендуется женщинам, желающим забеременеть.
Мелоксикам экскретируется в молоко лактирующих крыс, при этом концентрации в молоке превышают концентрации в плазме. Неизвестно, проникает ли мелоксикам в грудное молоко женщин, поэтому следует прекратить грудное вскармливание на время лечения или избегать применения мелоксикама в период грудного вскармливания.
Противопоказания к применениюГиперчувствительность (в т.ч. к другим НПВС), «аспириновая» триада (сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты и ЛС пиразолонового ряда), язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения; желудочно-кишечное, цереброваскулярное или иное кровотечение/кровоизлияние; тяжелая сердечная недостаточность, тяжелая печеночная недостаточность, тяжелая почечная недостаточность (если не проводится гемодиализ), беременность, кормление грудью, возраст до 15 лет.
Побочные действияСо стороны органов ЖКТ: >1% — диспепсия, тошнота, рвота, боль в животе, запор/диарея, метеоризм; 0,1–1% — стоматит, транзиторные изменения показателей функции печени (повышение уровня трансаминаз или билирубина), отрыжка, эзофагит, язва желудка и двенадцатиперстной кишки, скрытое или макроскопически видимое желудочно-кишечное кровотечение; 1% — головная боль, головокружение; 0,1–1% — вертиго, сонливость, шум в ушах; 1% — отеки, анемия; 0,1–1% — повышение АД, сердцебиение, приливы крови к лицу, изменения гемограммы, в т.ч. изменение количества отдельных типов лейкоцитов, лейкопения, тромбоцитопения.
Со стороны респираторной системы: обострение бронхиальной астмы, кашель.
Со стороны мочеполовой системы: 0,1–1% — изменение показателей функции почек (повышение уровня креатинина и/или мочевины крови); 1% — кожная сыпь, зуд; 0,1–1% — крапивница;